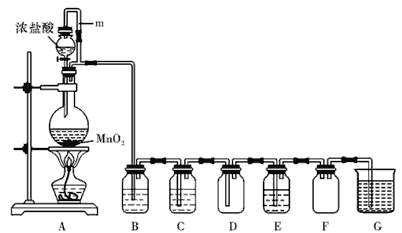
题目内容
【题目】(一)甲烷和氯气在光照条件下发生卤代反应,其反应机理如下:
反应①:![]() △H=242.7kJ·mol-1
△H=242.7kJ·mol-1
反应②:![]() △H=7.5kJ·mol-1
△H=7.5kJ·mol-1
反应③:![]() △H=-112.9kJ·mol-1
△H=-112.9kJ·mol-1
反应②、③反复循环,反应物浓度逐渐降低,自由基逐渐消失,反应停止。
(1)在该反应条件下断裂1mol CH3Cl中C—Cl键,需要吸收的能量为______。
(2)反应②与反应③的反应过程,如下图所示:
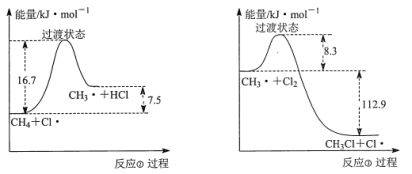
则该条件下,反应②的速率______反应③的速率(填“>”、“<”或“=”)。
(3)根据以上的反应机理,我们可以推测甲烷和氯气在光照条件下反应,除生成CH3Cl、CH2Cl2、CHCl3、CCl4外,还会有乙烷等有机物,原因是______。
(二)煤燃烧排放的SO2和NO2可形成严重的大气污染,某兴趣小组提出利用反应![]() 来处理。
来处理。
(4)在一定温度下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,达到平衡时NO2和SO2的体积之比为1:5,则该温度下平衡常数K为______。
(5)若向绝热恒容密闭容器中通入SO2和NO2,v正随时间变化如下图。下列结论正确的是______。
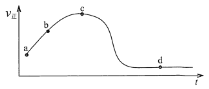
A. a点颜色比b点深
B. c点正反应速率等于逆反应速率
C. 若升高温度,d点SO2的转化率将增大
D. 反应的过程中,容器内气体压强保持不变
E. 若外界条件不发生改变,d点NO2和NO的体积比将保持不变
(6)若用一定浓度的NaClO2溶液(已调节其初始pH为5)充分吸收煤燃烧排放的烟气后,测得溶液中各物质的浓度如下表所示:

其中 NaClO2溶液吸收SO2的主要离子反应方程式为______。
(7)为消除NOx,科学家开发了一种能传导O2-的固态高温陶瓷电池,一极通氨气,另一极通NOx,生成无污染的常见气体和液体。写出该电池的正极反应式:______。
【答案】355.6kJ < 反应中存在CH3间的碰撞
1.8 AE ClO2-+2SO2+2H2O=Cl-+2SO42-+4H+ 2NOx+4xe-=N2+2xO2-
【解析】
(1)反应①:![]() △H=242.7kJmol-1,反应③:CH3+Cl2→Cl+CH3Cl△H=-112.9kJmol-1,根据盖斯定律①-③可得;
△H=242.7kJmol-1,反应③:CH3+Cl2→Cl+CH3Cl△H=-112.9kJmol-1,根据盖斯定律①-③可得;
(2)活化能小的反应反应速率较快;
(3)自由基之间的碰撞产生物质,CH3之间的碰撞可得到乙烷;
(4)NO2与SO2以体积比1:2置于密闭容器中,其物质的量之比也为1:2,令NO2与SO2分别为1mol、2mol,容器体积为VL,设平衡时消耗NO2为x mol列三段式有:
NO2(g)+SO2(g)SO3(g)+NO(g)
n起始: 1 2 0 0
n转化: x x x x
n平衡: 1-x 2-x x x
平衡时NO2和SO2的体积之比为1:5,故(1-x):(2-x)=1:5,解得x=0.75,据此计算;
(5)向恒容密闭容器中通入SO2和NO2,若为恒温,v正随时间变化减小直到不变,绝热条件下,v正随时间变化先增大后减小最终不变,说明温度升高,故该反应为放热反应,d点为平衡状态,根据温度对化学平衡的影响和化学平衡状态特征分析;
(6)根据图可知,吸收后溶液中氯元素以氯离子形式为主,硫元素以硫酸根离子为主,故反应为NaClO2在酸性条件下将二氧化硫氧化为硫酸根离子,自身被还原为氯离子,结合电荷守恒和质量守恒书写可得;
(7)正极得到电子发生还原反应,元素化合价降低,则为NOx放电生成氮气,据此书写。
(1)反应①:![]() △H=242.7kJmol-1,反应③:CH3+Cl2→Cl+CH3Cl△H=-112.9kJmol-1,根据盖斯定律①-③可得CH3Cl→CH3+Cl,△H=355.6kJ/mol,故在该反应条件下断裂1mol CH3Cl中C-Cl键,需要吸收的能量为355.6kJ;
△H=242.7kJmol-1,反应③:CH3+Cl2→Cl+CH3Cl△H=-112.9kJmol-1,根据盖斯定律①-③可得CH3Cl→CH3+Cl,△H=355.6kJ/mol,故在该反应条件下断裂1mol CH3Cl中C-Cl键,需要吸收的能量为355.6kJ;
(2)由图有反应②的活化能为16.7kJ/mol,反应③的活化能为8.3kJ/mol,反应③的活化能较低,反应速率较快,反应②的速率<反应③的速率;
(3)因为反应中存在CH3间的碰撞,故生成CH3Cl、CH2Cl2、CHCl3、CCl4外,还会有乙烷等有机物;
(4)NO2与SO2以体积比1:2置于密闭容器中,其物质的量之比也为1:2,令NO2与SO2分别为1mol、2mol,容器体积为VL,设平衡时消耗NO2为x mol列三段式有:
NO2(g)+SO2(g)SO3(g)+NO(g)
n起始: 1 2 0 0
n转化: x x x x
n平衡: 1-x 2-x x x
平衡时NO2和SO2的体积之比为1:5,故(1-x):(2-x)=1:5,解得x=0.75;
则该温度下平衡常数K为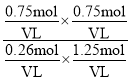 =1.8;
=1.8;
(5)向恒容密闭容器中通入SO2和NO2,若为恒温,v正随时间变化减小直到不变,绝热条件下,v正随时间变化先增大后减小,说明温度升高,故该反应为放热反应;
A.a点正反应速率较b点慢,说明a点的NO2浓度较b点大,颜色比b点深,故A正确;
B.正反应速率与逆反应速率相等,反应到达平衡,c点正反应速率正在变化,反应不是平衡状态,与逆反应速率不等,故B错误;
C.反应为放热反应,若升高温度,有利于逆反应方向,d点SO2的转化率将减小,故C错误;
D.该反应气体体积不变,反应的过程中,反应放热,气体受热膨胀,总体积不变,故容器内气体压强增大,故D错误;
E.若外界条件不发生改变,d点为平衡状态,各组分含量保持不变,故NO2和NO的体积比将保持不变,故E正确;
故答案为AE;
(6)用一定浓度的NaClO2溶液在酸性条件下充分吸收煤燃烧排放的烟气(SO2),根据图可知,吸收后溶液中氯元素以氯离子形式为主,硫元素以硫酸根离子为主,故反应为NaClO2在酸性条件下将二氧化硫氧化为硫酸根离子,自身被还原为氯离子,NaClO2溶液吸收SO2的主要离子反应方程式为:ClO2-+2SO2+2H2O=Cl-+2SO42+4H+;
(7)一极通氨气,另一极通NOx,生成无污染的常见气体和液体,说明生成氮气和水,正极得到电子发生还原反应,元素化合价降低,则为NOx放电生成氮气,电极反应为:2NOx+4xe-=N2+2xO2-。