题目内容
【题目】ZrO2是重要的耐温材料,可用作陶瓷遮光剂。天然锆英石(ZrSiO4)含有铁、铝、铜等金属元素的氧化物杂质,工业以锆英石为原料制备ZrO2的工艺流程如下: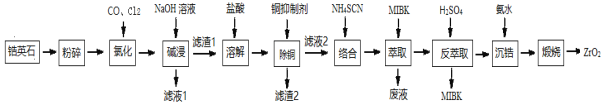
已知:①锆英石中锆元素的化合价为+4 ,“氯化”过程中除C、O元素外,其他元素均转化为最高价氯化物 ②SiCl4极易水解;ZrCl4易溶于水 ③Fe(SCN)3难溶于有机溶剂MIBK; Zr(SCN)4在水中溶解度不大,易溶于有机溶剂MIBK。
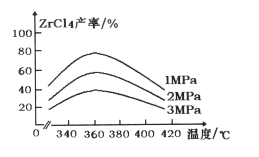
(1) “氯化”过程中,锆英石发生的主要反应的化学方程式为:______________________________,ZrC14的产率随温度变化如图所示,由图可知氯化的最佳条件是_____________;
(2)“滤液1”中含有的阴离子除OH- 、Cl-,还有___________________;
(3)常用的铜抑制剂有Na2S、H2S、NaCN等,本流程使用NaCN除铜,不采用Na2S、H2S的原因是__________。
(4)实验室进行萃取和反萃取的玻璃仪器是_______。流程中萃取与反萃取的目的是_________。
【答案】)ZrSiO4+4CO+4Cl2 ![]() ZrCl4 +SiCl4+4CO2 360℃、1MPa AlO2- 、SiO32- S2-会将Fe3+还原成Fe2+,影响下一步除铁,同时可能会产生污染性气体 分液漏斗、烧杯 除去铁元素杂质
ZrCl4 +SiCl4+4CO2 360℃、1MPa AlO2- 、SiO32- S2-会将Fe3+还原成Fe2+,影响下一步除铁,同时可能会产生污染性气体 分液漏斗、烧杯 除去铁元素杂质
【解析】
根据流程:天然锆石的主要成分是ZrSiO4(还常含有Fe、Al、Cu的氧化物杂质),将粉碎后的天然锆石用CO、Cl2氯化得到ZrCl4、SiCl4、AlCl3、FeCl3、CuCl2;用NaOH溶液碱浸时,SiCl4、AlCl3溶解为硅酸钠、偏铝酸钠,ZrCl4、FeCl3、CuCl2反应为Zr(OH)4、Fe(OH)3、Cu(OH)2沉淀,即为滤渣1;用盐酸溶解滤渣1得到ZrCl4、FeCl3、CuCl2;加入铜抑制剂除去铜[铜抑制剂可以为NaCN,生成沉淀为Cu(CN)2],滤渣2为Cu(CN)2;向滤液2加入NH4SCN与ZrCl4、FeCl3发生配合反应得到Fe(SCN)3、Zr(SCN)4,加入 有机溶剂MIBK萃取,Fe(SCN)3难溶于MIBK,分液,Zr(SCN)4在有机层,将含有Zr(SCN)4的有机层用硫酸反萃取将Zr(SCN)4与MIBK分离;通入氨气沉锆,经过煅烧得到ZrO2,据此分析作答。
(1) 氯化过程中ZrSiO4与CO、Cl2在高温下反应生成ZnCl4、SiCl4和CO2,反应的化学方程式为:ZrSiO4+4CO+4Cl2![]() ZnCl4+SiCl4+4CO2;由图可知,360℃、1MPa时,ZrCl4产率最高,此为氯化最佳条件;
ZnCl4+SiCl4+4CO2;由图可知,360℃、1MPa时,ZrCl4产率最高,此为氯化最佳条件;
(2)由流程分析可知,“滤液1”中含有的阴离子除OH- 、Cl-,还有AlO2- 、SiO32-;
(3)三价铁具有氧化性,S2-会将Fe3+还原成Fe2+,发生的反应为2Fe3++H2S=2Fe2++S+2H+(2Fe3++S2-=2Fe2++S),影响下一步除铁,同时可能会产生污染性H2S气体,故本流程使用NaCN除铜,不采用Na2S、H2S;
(4)实验室进行萃取和反萃取的玻璃仪器是分液漏斗、烧杯;根据已知信息“生成的Fe(SCN)3难溶于MIBK,Zr(SCN)4在水中的溶解度小于在MIBK中的溶解度”可知,流程中萃取与反萃取的目的是除去铁元素杂质。