题目内容
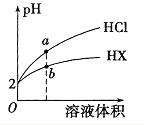
【题目】常温下,用0.1mol/LNaOH溶液滴定10mL0.1mol/LH2X溶液,溶液的pH与NaOH溶液的体积关系如图所示,下列说法正确的是

A.水电离出来的c(OH):D点<B点
B.C点存在关系式:c(Na+)=c(HX)+2c(X2)c(H+)
C.B点:c(Na+)>c(HX)>c(H+)>c(X2)>cH2X)
D.A点溶液中加入少量水:![]() 减小
减小
【答案】C
【解析】
A. D点溶质为Na2X,水解显碱性,B点溶质为NaHX,HX-的电离大于水解,溶液显酸性,抑制水的电离,因此水电离出来的c(OH):D点>B点,故A错误;
B. C点溶液中电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HX-)+2c(X2-),溶液呈中性即c(H+)=c(OH-),存在关系式:c(Na+)=c(HX)+2c(X2),故B错误;
C. B点溶质为NaHX,HX-的电离大于水解,溶液显酸性,离子浓度大小关系为:c(Na+)>c(HX)>c(H+)>c(X2)>cH2X),故C正确;
D. A点溶液中加入少量水,促进H2X的电离,由于溶液体积也增大,c(HX)减小,则![]() 增大,故D错误;
增大,故D错误;
综上所述,答案为C。

练习册系列答案
相关题目