题目内容
2.下列说法中正确的是( )| A. | 分子式为C4H9Cl的物质一共有4种结构 | |
| B. | 可以用酸性KMnO4溶液除去甲烷中的乙烯 | |
| C. | 2,2-二甲基丙烷中所有碳原子在同一平面上 | |
| D. | CH3-CH=CH-CH3与HCl发生加成反应,产物有两种 |
分析 A、丁基有4种;
B、高锰酸钾与乙烯发生氧化还原反应生成二氧化碳气体,引入新的杂质;
C、甲基为四面体结构,据此判断即可;
D、CH3-CH=CH-CH3是对称结构,与HCl加成产物只有一种.
解答 解:A、丁基有4种,故分子式为C4H9Cl的物质一共有4种结构,故A正确;
B、高锰酸钾与乙烯发生氧化还原反应生成二氧化碳气体,甲烷中引入了新的杂质气体:二氧化碳,不符合除杂原则,故B错误;
C、甲基为四面体结构,2,2-二甲基丙烷,即新戊烷中的五个碳中,四个甲基分别位于正四面体的顶点,不可能处于同一平面上,故C错误;
D、CH3-CH=CH-CH3是对称结构,与HCl加成产物只有一种,故D错误,故选A.
点评 本题考查的是有机物中烷烃取代基个数、甲烷与乙烯的性质、同分异构体判断、有机物结构等,综合性较强,难度不大.

练习册系列答案
相关题目
10.下列叙述不正确的是( )
| A. | 原子核外每层最多容纳的电子数为2n2个(n为电子层) | |
| B. | 同一原子核外的M层上的电子数一定比L层上的电子数多 | |
| C. | 如果原子只有一个电子层,该原子的质子数不超过2个 | |
| D. | 1~18号元素,每层电子数都满足2n2个电子的元素只有2种 |
17.下列物质中不含非极性共价键的是:①Na2O2 ②CCl4 ③O2 ④NH4Cl ⑤H2O2 ⑥Ca(OH)2( )
| A. | ①②③④ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ②③⑤ |
7.化学与能源开发、环境保护、生产生活等密切相关.下列有关说法正确的是( )
| A. | 二氧化硫可用于纸浆漂白,表明二氧化硫具有还原性 | |
| B. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| C. | 为防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| D. | Na2O2可用作呼吸面具的供氧剂 |
14.柠檬烯是一种食用香精,其结构简式为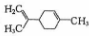 ,有关柠檬烯的分析正确的是( )
,有关柠檬烯的分析正确的是( )
 ,有关柠檬烯的分析正确的是( )
,有关柠檬烯的分析正确的是( )| A. | 一氯代物共有7种 | |
| B. | 分子中所有碳原子一定在同一平面 | |
| C. | 和丁基苯(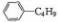 )互为同分异构体 )互为同分异构体 | |
| D. | 一定条件下,分别可以发生加成、取代、氧化反应 |
11.下表是3种物质的溶解度(20℃),下列说法中不正确的是( )
| 物质 | MgCl2 | Mg(OH)2 | MgCO3 |
| 溶解度(g/100g) | 74 | 0.000 84 | 0.01 |
| A. | 将表中三种物质与水混合,加热、灼烧,最终的固体产物相同 | |
| B. | 已知MgCO3的Ksp=6.82×10-6 mol2•L-2,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)•c(CO32-)=6.82×10-6 mol2•L-2 | |
| C. | 除去粗盐中含有的MgCl2杂质,最佳除杂试剂为NaOH溶液 | |
| D. | 用石灰水处理含有Mg2+和HCO3-的硬水,发生的离子反应方程式为Mg2++2HCO3-+2Ca2++4OH-═2CaCO3↓+Mg(OH)2↓+2H2O |
12.化学知识在工农业生产和日常生活中应用广泛.下列有关说法不正确的是( )
| A. | 金属钠着火时可用水扑灭 | |
| B. | 中秋月饼包装盒内常放入小袋生石灰作为干燥剂 | |
| C. | 铜质水龙头与铁质水管连接处容易发生电化学腐蚀导致生锈 | |
| D. | 盐碱地(含较多的NaCl、Na2CO3等)中施加适量石膏可降低土壤的碱性 |
 .
.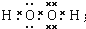 ;将乙加入浅绿色酸性溶液中,溶液变为棕黄色,写出该反应的离子方程式.
;将乙加入浅绿色酸性溶液中,溶液变为棕黄色,写出该反应的离子方程式. .与PH3相比,DC2易液化的主要原因是NH3中有氢键;
.与PH3相比,DC2易液化的主要原因是NH3中有氢键;