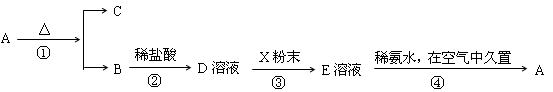
题目内容
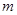 g铜与足量浓H2SO4共热时完全反应,在标准状况下生成
g铜与足量浓H2SO4共热时完全反应,在标准状况下生成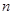 L气体,则被还原的H2SO4的量是
L气体,则被还原的H2SO4的量是A.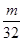 mol mol | B.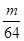 g g | C.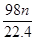 g g | D.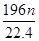 g g |
C
试题分析:铜和浓硫酸反应的化学方程式是Cu+2H2SO4(浓)
 CuSO4+2H2O+SO2↑,根据S原子守恒可知,被还原的硫酸是
CuSO4+2H2O+SO2↑,根据S原子守恒可知,被还原的硫酸是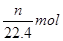 ,则质量就是
,则质量就是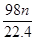 g,C正确。铜的物质的量是
g,C正确。铜的物质的量是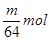 ,因此被还原的硫酸也是
,因此被还原的硫酸也是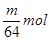 ,答案选C。
,答案选C。点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。该题的解题思路是借助于原子守恒进行的,另外也可以根据反应的化学方程式进行计算。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目