题目内容
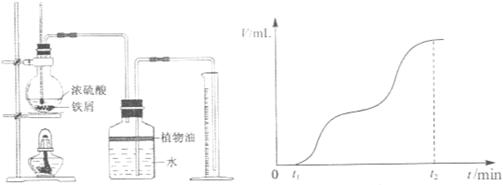
(7分)某固体化合物A,按下图所示发生系列变化,已知E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色。

(1)请写出下列物质的化学式:A 、C 。
(2)在①②③④各步反应中属于氧化还原反应的有 (填序号)。
(3)请分别写出反应②的化学方程式和反应③的离子方程式:② 、③ 。

(1)请写出下列物质的化学式:A 、C 。
(2)在①②③④各步反应中属于氧化还原反应的有 (填序号)。
(3)请分别写出反应②的化学方程式和反应③的离子方程式:② 、③ 。
(1)A:Fe(OH)3 C:H2O
(2)③④
(3)Fe2O3 +6HCl===2FeCl3+3H2O 2Fe3++Fe===3Fe2+
(2)③④
(3)Fe2O3 +6HCl===2FeCl3+3H2O 2Fe3++Fe===3Fe2+
试题分析:由“E溶液中加入氨水后产生的白色沉淀很快变为灰绿色,最后变为红褐色物质A”可推知A为氢氧化铁,则推知B为氧化铁,C为水,D为氯化铁,E为氯化亚铁。故
(1)A:Fe(OH)3 C:H2O
(2)①2Fe(OH)3
 Fe2O3 +3H2O,无化合价的变化,属于非氧化还原反应。
Fe2O3 +3H2O,无化合价的变化,属于非氧化还原反应。②Fe2O3 +6HCl=2FeCl3 +3H2O,无化合价的变化,属于非氧化还原反应。
③2FeCl3 +Fe=3FeCl2,Fe的化合价发生改变,属于氧化还原反应。
④4Fe(OH)2 +O2 +2H2O=4Fe(OH)3,Fe的化合价发生改变,属于氧化还原反应。
故答案是③④
(3)根据(2)的答案可知:Fe2O3 +6HCl===2FeCl3+3H2O 2Fe3++Fe===3Fe2+
点评:熟悉物质的特殊性质作为推断题的突破口。结合题目的信息逐一确定。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

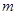 g铜与足量浓H2SO4共热时完全反应,在标准状况下生成
g铜与足量浓H2SO4共热时完全反应,在标准状况下生成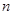 L气体,则被还原的H2SO4的量是
L气体,则被还原的H2SO4的量是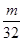 mol
mol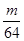 g
g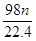 g
g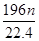 g
g Fe2(SO4)3 + 3SO2↑+ 6H2O。请你参与探究并回答相关问题。
Fe2(SO4)3 + 3SO2↑+ 6H2O。请你参与探究并回答相关问题。