题目内容
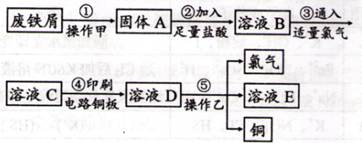
由废铁制备FeCl2的主要过程如下:
Ⅰ.按下图所示过程制备FeCl3?6H2O

(1)①中产生气体的电子式是 。
(2)用离子方程式表示过程②中稀硝酸的作用 ,在该过程中要不断向溶液中补充盐酸,目的是 。
Ⅱ.由FeCl3 ? 6H2O制得干燥FeCl2的过程如下:
ⅰ.向盛有FeCl3 ? 6H2O的容器中加入SOCl2,加热,获得无水FeCl3
ⅱ.将无水FeCl3置于反应管中,通入①中产生的气体一段时间后加热,生成FeCl2
ⅲ.收集FeCl2,保存备用
(3) SOCl2与水接触会迅速产生白雾和SO2。加热分解FeCl3 ? 6H2O不能得到无水FeCl3,而步骤ⅰ中可得到无水FeCl3,结合必要化学方程式解释得到无水FeCl3的原因 。
(4)过程ⅱ中产生FeCl2的化学方程式是 。
Ⅲ.FeCl2的包装上贴有安全注意事项,部分内容如下:
(5)下列说法正确的是 。
a.密闭保存、远离火源
b.可以与强氧化剂共同存放、运输
c.不宜用铁制容器包装而要用聚乙烯塑料桶包装
(6)FeCl2在空气中受热可生成氯化铁、氧化铁等,反应的化学方程式是 。
Ⅰ.按下图所示过程制备FeCl3?6H2O

(1)①中产生气体的电子式是 。
(2)用离子方程式表示过程②中稀硝酸的作用 ,在该过程中要不断向溶液中补充盐酸,目的是 。
Ⅱ.由FeCl3 ? 6H2O制得干燥FeCl2的过程如下:
ⅰ.向盛有FeCl3 ? 6H2O的容器中加入SOCl2,加热,获得无水FeCl3
ⅱ.将无水FeCl3置于反应管中,通入①中产生的气体一段时间后加热,生成FeCl2
ⅲ.收集FeCl2,保存备用
(3) SOCl2与水接触会迅速产生白雾和SO2。加热分解FeCl3 ? 6H2O不能得到无水FeCl3,而步骤ⅰ中可得到无水FeCl3,结合必要化学方程式解释得到无水FeCl3的原因 。
(4)过程ⅱ中产生FeCl2的化学方程式是 。
Ⅲ.FeCl2的包装上贴有安全注意事项,部分内容如下:
| 品 名 | 氯化亚铁 |
| 理化特性 | 白色,遇空气易变成黄色,易吸水,有腐蚀性…… |
| 注意事项 | 避免接触空气、碱等;聚乙烯塑料桶包装;避免受热 |
(5)下列说法正确的是 。
a.密闭保存、远离火源
b.可以与强氧化剂共同存放、运输
c.不宜用铁制容器包装而要用聚乙烯塑料桶包装
(6)FeCl2在空气中受热可生成氯化铁、氧化铁等,反应的化学方程式是 。
(1) (1分)
(1分)
(2)3Fe2+ + NO3- + 4H+ ="3" Fe3+ + NO↑+ 2H2O (2分)
补充H+,使NO3-继续氧化Fe2+,直至NO3-完全消耗,既不产生Fe(NO3)3,又不引入其他杂质(2分)
(3) 6SOCl2 + FeCl3?6H2O = FeCl3 + 12HCl↑+ 6SO2↑,生成的HCl会抑制FeCl3的水解,得到无水FeCl3(2分)
(4)2FeCl3 + H2 △ 2FeCl2 + 2HCl(2分)
(5)a c (1分)
(6)4FeCl2 + H2O + O2 △ 2FeCl3 + Fe2O3+ 2HCl(2分)
 (1分)
(1分)(2)3Fe2+ + NO3- + 4H+ ="3" Fe3+ + NO↑+ 2H2O (2分)
补充H+,使NO3-继续氧化Fe2+,直至NO3-完全消耗,既不产生Fe(NO3)3,又不引入其他杂质(2分)
(3) 6SOCl2 + FeCl3?6H2O = FeCl3 + 12HCl↑+ 6SO2↑,生成的HCl会抑制FeCl3的水解,得到无水FeCl3(2分)
(4)2FeCl3 + H2 △ 2FeCl2 + 2HCl(2分)
(5)a c (1分)
(6)4FeCl2 + H2O + O2 △ 2FeCl3 + Fe2O3+ 2HCl(2分)
试题分析:铁和盐酸反应生成FeCl2和氢气,加入硝酸氧化为FeCl3,还有盐酸抑制Fe3+的水解,补充H+,使NO3-继续氧化Fe2+,直至NO3-完全消耗,既不产生Fe(NO3)3,又不引入其他杂质,最后结晶获得晶体。

练习册系列答案
相关题目

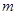 g铜与足量浓H2SO4共热时完全反应,在标准状况下生成
g铜与足量浓H2SO4共热时完全反应,在标准状况下生成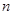 L气体,则被还原的H2SO4的量是
L气体,则被还原的H2SO4的量是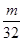 mol
mol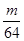 g
g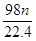 g
g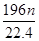 g
g