题目内容
把一定量的铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为 ( )
| A.1:1 | B.1:2 | C.2:3 | D.3:2 |
C
试题分析:
Fe +2Fe3+=3Fe2+
1 2 3
从上述离子方程式得,若反应2molFe3+(即已反应的Fe3+),生成3molFe2+而所得溶液中Fe2+和Fe3+的溶度恰好相等,即未反应的Fe3+的物质的量为3mol所以答案2:3,故选C。3+和Fe2+的转换的计算
点评:本题考查Fe3+和Fe2+的转换的计算,只需列出反应方程式,通过假设即可算出,不难理解。

练习册系列答案
相关题目
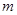 g铜与足量浓H2SO4共热时完全反应,在标准状况下生成
g铜与足量浓H2SO4共热时完全反应,在标准状况下生成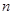 L气体,则被还原的H2SO4的量是
L气体,则被还原的H2SO4的量是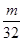 mol
mol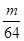 g
g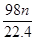 g
g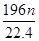 g
g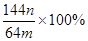 。该学生的计算是否正确: ,请说明理由 。
。该学生的计算是否正确: ,请说明理由 。