题目内容
用铜和浓硫酸反应,得到SO2的体积为2.24L(标准状况)。
(1)试计算被还原的硫酸的物质的量。
(2)将得到的CuSO4溶液加水配成500ml溶液,则500mlCuSO4溶液中CuSO4的的物质的量浓度是多少?
(1)试计算被还原的硫酸的物质的量。
(2)将得到的CuSO4溶液加水配成500ml溶液,则500mlCuSO4溶液中CuSO4的的物质的量浓度是多少?
(6分)(1)0.1mol (2)0.2mol·L-1
试题分析:(1)浓硫酸被还原生成二氧化硫,因此被还原的硫酸的物质的量等于二氧化硫的物质的量,即2.24L÷22.4L/mol=0.1mol。
(2)根据反应式Cu+2H2SO4(浓)
 CuSO4+2H2O+SO2↑可知
CuSO4+2H2O+SO2↑可知生成的硫酸铜的物质的量等于SO2的物质的量,都是0.1mol
所以硫酸铜的浓度是0.1mol÷0.5L=0.2mol/L
点评:该题是基础性的试题的考查。试题基础性强,难易适中。该题的关键是明确浓硫酸与铜的反应原理,然后结合题意灵活运用即可,有利于培养学生的逻辑推理能力和规范答题能力,提高学生灵活运用知识解决实际问题的能力。

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
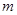 g铜与足量浓H2SO4共热时完全反应,在标准状况下生成
g铜与足量浓H2SO4共热时完全反应,在标准状况下生成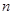 L气体,则被还原的H2SO4的量是
L气体,则被还原的H2SO4的量是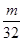 mol
mol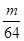 g
g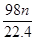 g
g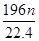 g
g