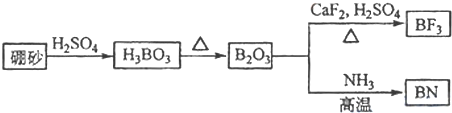
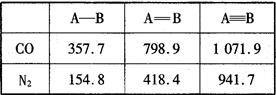
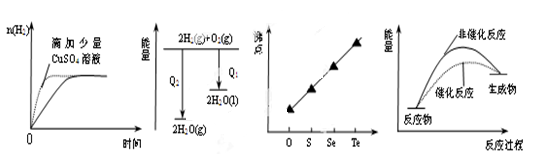
题目内容
ⅤA族的氮、磷、砷(As)、锑(Sb)等元素在化合物中常表现出多种氧化态,含ⅤA族元素的化合物在科研和生产中有许多重要用途。请回答下列问题:
(1)N、P、As原子的第一电离能由大到小的顺序为 (用元素符号表示)。
(2)As原子核外M层电子的排布式为 。
(3)叠氮化钠(NaN3)用于汽车安全气囊中氮气的发生剂,写出与N互为等电子体的分子的化学式 (任写一种即可)。

图1
(4)白磷(P4)的结构如图1所示,P原子的轨道杂化方式是 。
(5) 可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。
可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。
① 的立体构型是 。
的立体构型是 。
②在K3[Co(NO2)6]中,中心离子的配位数为 。
(6)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫丝氨酸(HOCH2CHCOOHNH2)。判断丝氨酸是否存在手性异构体? (填“是”或“否”)。

图2
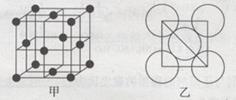
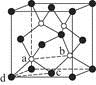
(7)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图2所示,其晶胞边长为cpm,则密度为 g·cm-3(用含c的式子表示,设NA为阿伏加德罗常数的值),a位置As原子与b位置As原子之间的距离为 pm(用含c的式子表示)。
(1)N、P、As原子的第一电离能由大到小的顺序为 (用元素符号表示)。
(2)As原子核外M层电子的排布式为 。
(3)叠氮化钠(NaN3)用于汽车安全气囊中氮气的发生剂,写出与N互为等电子体的分子的化学式 (任写一种即可)。

图1
(4)白磷(P4)的结构如图1所示,P原子的轨道杂化方式是 。
(5)
 可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。
可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。①
 的立体构型是 。
的立体构型是 。②在K3[Co(NO2)6]中,中心离子的配位数为 。
(6)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫丝氨酸(HOCH2CHCOOHNH2)。判断丝氨酸是否存在手性异构体? (填“是”或“否”)。

图2
(7)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图2所示,其晶胞边长为cpm,则密度为 g·cm-3(用含c的式子表示,设NA为阿伏加德罗常数的值),a位置As原子与b位置As原子之间的距离为 pm(用含c的式子表示)。
(1)N>P>As
(2)3s23p63d10
(3)CO2或CS2或N2O(任写一种,写成SiO2等原子晶体形式不正确)
(4)sp3
(5)①V形或角形或折线形
②6
(6)是
(7) ,
, 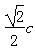 (说明:如图所示,平行四边形abcd中ab=cd=
(说明:如图所示,平行四边形abcd中ab=cd=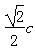 )
)
(2)3s23p63d10
(3)CO2或CS2或N2O(任写一种,写成SiO2等原子晶体形式不正确)
(4)sp3
(5)①V形或角形或折线形
②6
(6)是
(7)
 ,
, 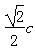 (说明:如图所示,平行四边形abcd中ab=cd=
(说明:如图所示,平行四边形abcd中ab=cd=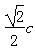 )
)
(1)同一主族元素的原子半径越大,越易失去电子,电离能越小。(3)等电子体指原子总数相等,价电子总数相等的粒子。(4)白磷分子中每个P原子有一个孤电子对,形成了3个σ键,故采取sp3杂化。(5)NO中氮原子的孤电子对数为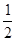 ×(5+1-2×2)=1,与O原子形成了2个σ键,采取sp2杂化,
×(5+1-2×2)=1,与O原子形成了2个σ键,采取sp2杂化, 为角形。(6)丝氨酸中连接氨基的碳原子上连接的四个原子或原子团均不相同,该碳原子为手性碳原子。(7)每个晶胞中含有砷原子个数4个,镓原子个数为8×
为角形。(6)丝氨酸中连接氨基的碳原子上连接的四个原子或原子团均不相同,该碳原子为手性碳原子。(7)每个晶胞中含有砷原子个数4个,镓原子个数为8×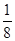 +6×
+6×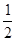 =4,则晶体密度为
=4,则晶体密度为 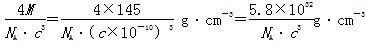
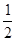 ×(5+1-2×2)=1,与O原子形成了2个σ键,采取sp2杂化,
×(5+1-2×2)=1,与O原子形成了2个σ键,采取sp2杂化, 为角形。(6)丝氨酸中连接氨基的碳原子上连接的四个原子或原子团均不相同,该碳原子为手性碳原子。(7)每个晶胞中含有砷原子个数4个,镓原子个数为8×
为角形。(6)丝氨酸中连接氨基的碳原子上连接的四个原子或原子团均不相同,该碳原子为手性碳原子。(7)每个晶胞中含有砷原子个数4个,镓原子个数为8×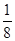 +6×
+6×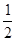 =4,则晶体密度为
=4,则晶体密度为 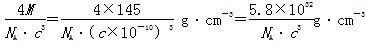

练习册系列答案
相关题目