题目内容
氮、磷、锌、铁等是与生命活动密不可分的元素。请回答下列问题:
(1) NH3和PH3都是极性分子,其中极性较大的是______,理由是 。
(2) 20mL0.1 mol·L-1次磷酸(H3PO2)溶液与20 mL 0.1 mol·L-1 NaOH溶液恰好中和生成正盐,则H3PO2的结构式是 。
(3) 下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式


血红素中N原子的杂化方式为 ,在右图的方框内用“→”标出Fe2+的配位键。
(4) N2与CO互为等电子体。下表是两者的键能
数据(单位:kJ·mol-1):
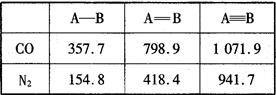
结合数据说明CO比N2活泼的原因:_____。
(5) Zn2+基态时的电子排布式是______,ZnO和ZnS的晶体结构相似,其中熔点较高的是______,理由是 。
(1) NH3和PH3都是极性分子,其中极性较大的是______,理由是 。
(2) 20mL0.1 mol·L-1次磷酸(H3PO2)溶液与20 mL 0.1 mol·L-1 NaOH溶液恰好中和生成正盐,则H3PO2的结构式是 。
(3) 下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式


血红素中N原子的杂化方式为 ,在右图的方框内用“→”标出Fe2+的配位键。
(4) N2与CO互为等电子体。下表是两者的键能
数据(单位:kJ·mol-1):

结合数据说明CO比N2活泼的原因:_____。
(5) Zn2+基态时的电子排布式是______,ZnO和ZnS的晶体结构相似,其中熔点较高的是______,理由是 。
(1)NH3;N的电负性大于P
(2)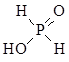
(3)sp3杂化;sp2杂化;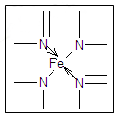
(4)断裂第一个π键消耗能量:CO 273KJ/mol 小于 N2 523.3 KJ/mol,CO中的第一个π键更容易断裂,故CO比N2活泼
(5)[Ar]3d10;ZnO; 同属于离子晶体,O2-半径小于S2-,故ZnO晶格能大(或离子键强),熔点高
(2)
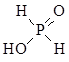
(3)sp3杂化;sp2杂化;

(4)断裂第一个π键消耗能量:CO 273KJ/mol 小于 N2 523.3 KJ/mol,CO中的第一个π键更容易断裂,故CO比N2活泼
(5)[Ar]3d10;ZnO; 同属于离子晶体,O2-半径小于S2-,故ZnO晶格能大(或离子键强),熔点高
试题分析:(1)因为N的电负性大于P,故 NH3的极性较大;(2)20mL0.1 mol·L-1次磷酸(H3PO2)溶液与20 mL 0.1 mol·L-1 NaOH溶液恰好中和生成正盐,二者物质的量之比为1:1,故H3PO2为一元酸,故其结构应为
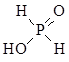 。(3)根据N原子的价电子排布式2s22p3,若N原子形成3个共价键,则氮原子周围还有一对孤对电子,即此时无配位键,该氮原子为sp3杂化,若N原子形成4个共价键,则必有一个是配位键,若还存在双键(双键视为单键),则该氮原子为sp2杂化;含有双键的氮原子存在孤对电子,可形成配位键,如图所示
。(3)根据N原子的价电子排布式2s22p3,若N原子形成3个共价键,则氮原子周围还有一对孤对电子,即此时无配位键,该氮原子为sp3杂化,若N原子形成4个共价键,则必有一个是配位键,若还存在双键(双键视为单键),则该氮原子为sp2杂化;含有双键的氮原子存在孤对电子,可形成配位键,如图所示 。
。(4)根据所给数据可知断裂第一个π键消耗能量:CO为273KJ/mol 小于 N2为523.3 KJ/mol,即CO中的第一个π键更容易断裂,故CO比N2活泼。(5) Zn为30号元素,基态时的电子排布式是[Ar]3d104s2,故Zn2+基态时的电子排布式是[Ar]3d10,ZnO和ZnS同属于离子晶体,O2-半径小于S2-,故ZnO晶格能大(或离子键强),熔点高。

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目



 ,则分子中 σ 键与 π 键之比为
,则分子中 σ 键与 π 键之比为 
 则其化学式为 ;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为 g/cm3。
则其化学式为 ;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为 g/cm3。

 可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。
可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。