题目内容
10.用NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 用含0.1mol FeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体中胶粒数为0.1NA | |
| B. | 0.1mol Fe 与0.1mol Cl2充分反应,转移的电子数为0.3 NA | |
| C. | 46g NO2和N2O4的混合气体中含N原子总数为NA | |
| D. | 等物质的量的NH4+和OH-含电子数均为10NA |
分析 A、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
B、等物质的量铁和氯气反应生成氯化铁,铁过量,反应的电子转移根据氯气计算;
C、NO2和N2O4的最简式均为NO2;
D、NH4+和OH-的物质的量不明确.
解答 解:A、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故0.1mol FeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体中胶粒数小于0.1NA,故A错误;
B、等物质的量铁和氯气反应生成氯化铁,铁过量,反应的电子转移根据氯气计算,转移电子数0.2NA,故B错误;
C、NO2和N2O4的最简式均为NO2,故46g混合气体中NO2的物质的量n=$\frac{46g}{46g/mol}$=1mol,故含有1mol氮原子,即NA个,故C正确;
D、NH4+和OH-均为10电子微粒,但NH4+和OH-的物质的量只是相等,但具体是几摩尔不明确,故等物质的量的NH4+和OH-含电子数不一定是10NA,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
20.下列化合物中既有离子键又有共价键的是( )
| A. | KBr | B. | NaOH | C. | HBr | D. | MgCl2 |
1.在恒温下的密闭容器中,有可逆反应:2NO(g)+O2(g)?2NO2(g)(反应放热),能说明已达到平衡状态的是( )
| A. | 正反应生成NO2的速率和逆反应生成O2的速率相等 | |
| B. | N2O4和NO2的浓度相等 | |
| C. | 混合气体的颜色保持不变 | |
| D. | 单位时间内生成1mol O2的同时,生成1molNO |
18.下列实验中,不能观察到明显变化的是( )
| A. | 把Cl2通入FeCl2溶液中 | |
| B. | 把绿豆大的钾投入少量水中 | |
| C. | 把一段打磨过的镁带放入少量冷水中 | |
| D. | 把溴水滴加到淀粉KI溶液中 |
5.下面选项中是2,3-二甲基-2-丁烯的结构简式的是( )
| A. | 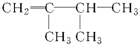 | B. | 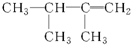 | C. |  | D. | 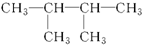 |
15.有机物A的结构简式为 :则A的同分异构体中带苯环的化合物共有( )
:则A的同分异构体中带苯环的化合物共有( )
 :则A的同分异构体中带苯环的化合物共有( )
:则A的同分异构体中带苯环的化合物共有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
2.单斜硫和正交硫转化为二氧化硫的能量变化如图所示,下列说法不正确的是( )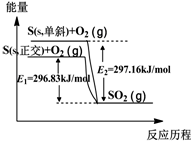

| A. | 单斜硫和正交硫互为同素异形体 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 相同物质的量的正交硫比单斜硫所含有的能量高 | |
| D. | 由单斜硫制取正交硫是一个放热反应 |
19.下列说法中错误的是( )
| A. | 原子间通过共用电子对所形成的化学键叫共价键 | |
| B. | 成键原子间原子轨道重叠越多,共价键越牢固 | |
| C. | 对双原子分子来讲,键能越大,含有该键的分子越稳定 | |
| D. | 键长越长,化学键越牢固 |