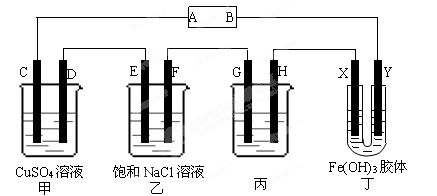
题目内容
海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | S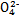 | HC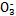 |
| 含量/(mg·L-1) | 9 360 | 83 | 200 | 1 100 | 16 000 | 1 200 | 118 |
(1)海水显弱碱性的原因是(用离子方程式表示): ,该海水中Ca2+的物质的量浓度为 mol·L-1。
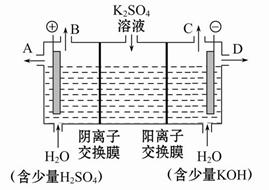
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。
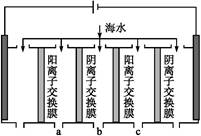
电渗析原理示意图
①阴极的电极反应为 。
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式: 。
③淡水的出口为a、b、c中的 出口。
(1)HC +H2O
+H2O H2CO3+OH- 5×10-3
H2CO3+OH- 5×10-3
(2)①2H2O+2e- H2↑+2OH-(或2H++2e-
H2↑+2OH-(或2H++2e- H2↑)
H2↑)
②Ca2++OH-+HC
 CaCO3↓+H2O ③b
CaCO3↓+H2O ③b
解析

练习册系列答案
相关题目
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
(1)写出甲中正极的电极反应式_____________________________。
(2)乙中负极为________,总反应的离子方程式:
______________________________________________________。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强。(填写元素符号)
(4)由此实验得出的下列结论中,正确的有________。
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动性顺序表已过时,没有实用价值了 |
| D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析 |
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了27g。常温下各烧杯中溶液的pH与电解时间(t)的关系如图。据此回答下列问题:
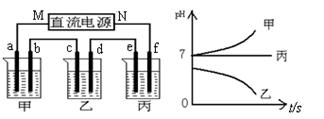
(1)M为电源的 极(填“正”或“负”),甲电解质为 (填化学式)。
(2)写出丙烧杯中反应的化学方程式 。
(3)有人设想用图一所示原电池为直流电源完成上述电解。则锌电极相当于直流电源的 (填“M”或“N”)极。
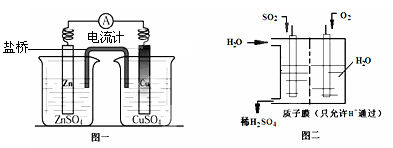
(4)有人设想用图二所示装置做直流电源,不仅可以完成电解也能将气体SO2转化
为重要化工原料。该设想中负极的电极反应式为 。

 2LiH
2LiH