题目内容
氢氧燃料电池是符合绿色化学理念的新型发电装置。
下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因为 。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2 2LiH
2LiH
Ⅱ.LiH+H2O=LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②由LiH与H2O作用,放出的224L(标准状况)H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
(1)由化学能转变为电能(1分) 由a到b(1分)
(2)2H2+4OH—-4e-=4H2O或H2+2OH—-2e-=2H2O(2分)
(3)增大电极单位面积吸附H2、O2分子数,加快电极反应速率;或增大电极上H2、O2气体的浓度,加快反应速率。(2分)
(4)①Li(1分) H2O (1分) ②16(2分)
解析试题解析:(1)氢氧燃料电池是利用了原电池的工作原理,所以是把化学能转化为电能的装置。在装置中,电子的流向是从负极流向正极,图中a为负极,b为正极,所以电子从a流向b。
(2)负极是氢气发生氧化反应,结合电解质溶液,电极反应式为2H2+4OH—-4e-=4H2O或H2+2OH—-2e-=2H2O。
(3)由题目中所述,铂吸附气体的能力强,性质稳定,所以电极表面镀铂粉的目的是增大电极单位面积吸附H2、O2分子数,加快电极反应速率;或者是增大电极上H2、O2气体的浓度,加快反应速率。
(4)①还原剂是指元素化合价升高的物质,在Ⅰ中Li的化合价升高,所以Li是还原剂;氧化剂是指元素化合价降低的物质,在Ⅱ中H2O中氢元素的化合价降低,所以H2O作氧化剂。
②放出的H2的物质的量为10mol,由于能量转化率为80%,实际参加反应的H2的物质的量为10mol×80%=8mol, H2的物质的量为8mol, H2-2e-=2H+则导线上通过的电子的物质的量为8mol×2=16mol。
考点:考查氢氧燃料电池的工作原理、电子流向、相应计算

甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=206.0 kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) ΔH=-129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为______________________________________________________。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如右图。
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为________。
②100 ℃时反应Ⅰ的平衡常数为________。
(3)在压强为0.1 MPa、温度为300 ℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原来的 ,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
| A.c(H2)减少 |
| B.正反应速率加快,逆反应速率减慢 |
| C.CH3OH 的物质的量增加 |
| D.重新平衡c(H2)/c(CH3OH)减小 |
(4)写出甲醇-空气-KOH溶液的燃料电池负极的电极反应式:__________________________________________________。

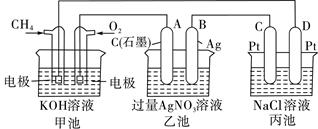
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:
①写出阳极电极反应式____________________________。
②写出除去甲醇的离子方程式__________________________________。
海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | S | HC |
| 含量/(mg·L-1) | 9 360 | 83 | 200 | 1 100 | 16 000 | 1 200 | 118 |
(1)海水显弱碱性的原因是(用离子方程式表示): ,该海水中Ca2+的物质的量浓度为 mol·L-1。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。
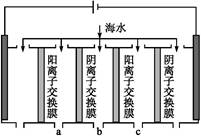
电渗析原理示意图
①阴极的电极反应为 。
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式: 。
③淡水的出口为a、b、c中的 出口。



 Li2FeSiO4+Li2SO4+SiO2。
Li2FeSiO4+Li2SO4+SiO2。 胶体
胶体 干凝胶
干凝胶 Li2FeSiO4。
Li2FeSiO4。 Li2FeSiO4,则该电池的负极是________;充电时,阳极反应的电极反应式为________。
Li2FeSiO4,则该电池的负极是________;充电时,阳极反应的电极反应式为________。