题目内容
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6 mol·L-1的H2SO4溶液中,乙同学将电极放入6 mol·L-1的NaOH溶液中,如图所示。
(1)写出甲中正极的电极反应式_____________________________。
(2)乙中负极为________,总反应的离子方程式:
______________________________________________________。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强。(填写元素符号)
(4)由此实验得出的下列结论中,正确的有________。
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
| B.镁的金属性不一定比铝的金属性强 |
| C.该实验说明金属活动性顺序表已过时,没有实用价值了 |
| D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析 |
(1)2H++2e-=H2↑
(2)Al 2Al+2OH-+2H2O=2AlO2-+3H2↑
(3)Mg Al
(4)AD
解析

某原电池装置中盛有浓KOH溶液,若分别向__________(填“正”或“负”,下同)极通入可燃性气体,向__________极通入O2,则电路中就有电流通过,电流方向由__________极流向__________极,溶液中OH-向__________极移动。试完成下列问题:
| | 可燃性气体 | 正极反应 | 负极反应 | 电池总反应 | pH变化 |
| (1) | H2 | | | | |
| (2) | CO | | | | |
| (3) | CH4 | | | |
化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极):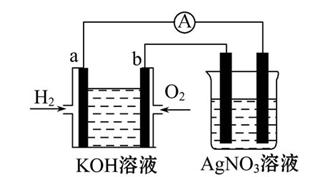
(1)对于氢氧燃料电池,下列表达不正确的是 。
| A.a电极是负极,OH-移向负极 |
| B.b电极的电极反应为:O2+2H2O+4e-=4OH- |
C.电池总反应式为:2H2+O2 2H2O 2H2O |
| D.电解质溶液的pH保持不变 |
(2)上图装置中盛有100 mL 0.1 mol·L-1 AgNO3溶液,当氢氧燃料电池中消耗氢气112 mL(标准状况下)时,此时图中装置中溶液的pH= (溶液体积变化忽略不计)。
Ⅱ.已知甲醇的燃烧热ΔH为-726.5 kJ·mol-1,在直接以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为 ,正极的反应式为 。
理想状态下,该燃料电池消耗1 mol甲醇所能产生的最大电能为702.1 kJ,则该燃料电池的理论效率为 (燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)。
海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | S | HC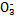 |
| 含量/(mg·L-1) | 9 360 | 83 | 200 | 1 100 | 16 000 | 1 200 | 118 |
(1)海水显弱碱性的原因是(用离子方程式表示): ,该海水中Ca2+的物质的量浓度为 mol·L-1。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。
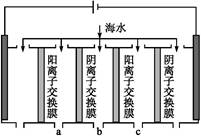
电渗析原理示意图
①阴极的电极反应为 。
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式: 。
③淡水的出口为a、b、c中的 出口。


 。实验过程中,两极均有气体产生,Y极区溶液逐渐生成
。实验过程中,两极均有气体产生,Y极区溶液逐渐生成
 2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:

