题目内容
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
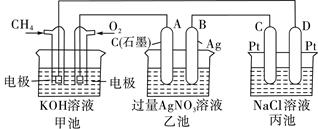
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、 B、 C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了27g。常温下各烧杯中溶液的pH与电解时间(t)的关系如图。据此回答下列问题:
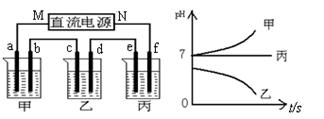
(1)M为电源的 极(填“正”或“负”),甲电解质为 (填化学式)。
(2)写出丙烧杯中反应的化学方程式 。
(3)有人设想用图一所示原电池为直流电源完成上述电解。则锌电极相当于直流电源的 (填“M”或“N”)极。
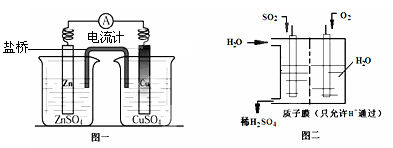
(4)有人设想用图二所示装置做直流电源,不仅可以完成电解也能将气体SO2转化
为重要化工原料。该设想中负极的电极反应式为 。
(1)负 NaCl;(2)2H2O 2H2↑+O2↑; (3) M; (4) SO2+2H2O-2e-=4H++SO42-
2H2↑+O2↑; (3) M; (4) SO2+2H2O-2e-=4H++SO42-
解析试题分析:(1)因为Ag+会与SO42-、Cl-发生离子反应产生沉淀,所以只能是AgNO3溶液。则另外的两种电解质溶液分别是Na2SO4、NaCl溶液。由于乙烧杯C电极增重,则乙烧杯的溶液为AgNO3溶液。C电极增重说明C为阴极,直流电源电极M为负极,N为正极。AgNO3溶液电解的方程式为:4AgNO3+2H2O 4Ag+O2↑+4HNO3.随着电解的进行,溶液的酸性逐渐增强。(2)由于丙溶液在电解的过程中溶液的PH不变,所以实质上是电解水。应该是活泼金属的含氧酸盐。丙溶液为Na2SO4。电解的方程式为2H2O
4Ag+O2↑+4HNO3.随着电解的进行,溶液的酸性逐渐增强。(2)由于丙溶液在电解的过程中溶液的PH不变,所以实质上是电解水。应该是活泼金属的含氧酸盐。丙溶液为Na2SO4。电解的方程式为2H2O 2H2↑+O2↑则甲溶液为NaCl。电解的方程式为2NaCl+2H2O
2H2↑+O2↑则甲溶液为NaCl。电解的方程式为2NaCl+2H2O Cl2↑+H2↑+2NaOH。(3)若用如图所示Zn-Cu原电池作直流电源,则活动性较强的Zn作电源的负极相当于直流电源的M极。(4)若用图二所示装置做直流电源,不仅可以完成电解也能将气体SO2转化为重要化工原料。根据如图所说的装置可知SO2被氧化为H2SO4,所以通入SO2气体的电极为负极,电极反应式为SO2+2H2O-2e-=4H++SO42-。通入O2的电极为正极,电极反应式为O2+4e-+4H+=2H2O。
Cl2↑+H2↑+2NaOH。(3)若用如图所示Zn-Cu原电池作直流电源,则活动性较强的Zn作电源的负极相当于直流电源的M极。(4)若用图二所示装置做直流电源,不仅可以完成电解也能将气体SO2转化为重要化工原料。根据如图所说的装置可知SO2被氧化为H2SO4,所以通入SO2气体的电极为负极,电极反应式为SO2+2H2O-2e-=4H++SO42-。通入O2的电极为正极,电极反应式为O2+4e-+4H+=2H2O。
考点:考查电源的电极的判断、盐溶液的电解原理及特点与原电池、电解池的电极反应式的书写的知识。

海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | S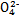 | HC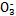 |
| 含量/(mg·L-1) | 9 360 | 83 | 200 | 1 100 | 16 000 | 1 200 | 118 |
(1)海水显弱碱性的原因是(用离子方程式表示): ,该海水中Ca2+的物质的量浓度为 mol·L-1。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。
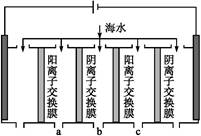
电渗析原理示意图
①阴极的电极反应为 。
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式: 。
③淡水的出口为a、b、c中的 出口。
迄今为止,由化学能转变的热能或电能仍然是人类使用的主要的能源。
I.请仔细观察下列两种电池的构造示意图,完成下列问题: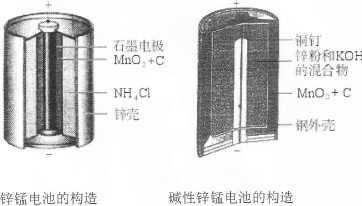
(1)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是 。
(2)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的电极反应式为 。
Ⅱ.下面是一个将化学能与电能相互转化的装置。回答下列问题: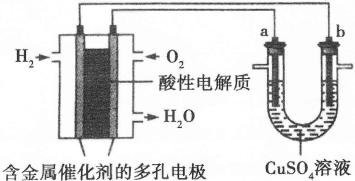
(1)写出通入O2一极的电极反应方程式为 。
(2)a电极是 极,能否写出其电极反应方程式 (填“能”或“不能”),若“能”写出其电极反应方程式,若“不能”说明其理由 。
(3)下列说法不正确的是( )
| A.此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变 |
| B.U型管中,OH—在a极放电 |
| C.若a为纯净金属,b为粗制金属,该装置可用于粗制金属的精炼 |
| D.电子经导线流入b电极 |


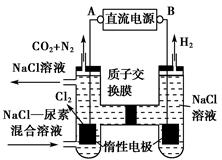
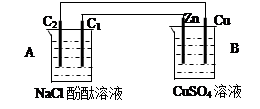
 (1)工业上可利用反应Na(1)+ KCl(1) K(g)+ NaCl(1)来治炼金属钾,此反应利用了钠的还原性及___ _____,
(1)工业上可利用反应Na(1)+ KCl(1) K(g)+ NaCl(1)来治炼金属钾,此反应利用了钠的还原性及___ _____,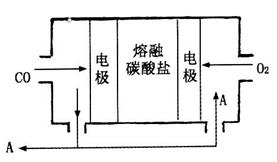

 沉淀完全,而在pH≥3.2时
沉淀完全,而在pH≥3.2时
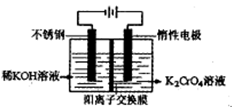
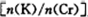 为d,则此时的铬酸钾的转化率为 。
为d,则此时的铬酸钾的转化率为 。