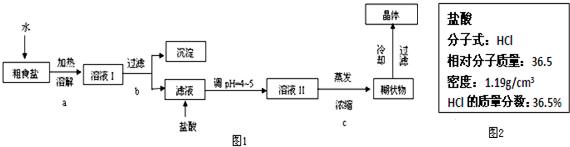
题目内容
7.向某密闭容器中加入1mol N2和3mol H2,平衡后测得NH3的体积分数为20%.(1)在恒温恒容下,向密闭容器中加入0.3mol N2,x mol H2和y mol NH3,达到平衡后,NH3的体积分数仍为20%,则x=0.9mol,y=1.4mol.
(2)在恒温恒压下,按下列方式投料起始反应,平衡时NH3的体积分数仍为20%的有①②(填序号).
①n(N2)=0,n(H2)=0,n(NH3)=4mol
②n(N2)=$\frac{1}{3}$mol,n(H2)=1mol,n(NH3)=0
③n(N2)=1mol,n(H2)=0,n(NH3)=2mol.
分析 (1)恒温恒容的条件下,只改变起始加入量,使之反应平衡后NH3的体积分数仍为20%,说明反应后达到的平衡与原平衡为完全等效平衡,二者为完全等效平衡,按化学计量数转化到左边,一定满足n(N2)=1mol、n(H2)=3mol;
(2)在恒温恒压下,按下列方式投料起始反应,平衡时NH3的体积分数仍为20%,说明反应后达到的平衡与原平衡为成比例等效平衡,按化学计量数转化到左边,必须满足n(N2):n(H2)=1:3.
解答 解:(1)根据题意可知,恒温恒容条件下,改变起始加入量,使之反应平衡后NH3的体积分数仍为m,两平衡为完全等效平衡,按化学计量数将氨气的物质的量转化成氮气和氢气的物质的量,一定满足:n(N2)=1mol、n(H2)=3mol,由N2(g)+3H2(g)?2NH3(g)可知,则有:0.3+0.5y=1、x+1.5y=3,解得x=0.9,y=1.4,故答案为:0.9;1.4;
(2)在恒温恒压下,按下列方式投料起始反应,平衡时NH3的体积分数仍为20%,说明反应后达到的平衡与原平衡为成比例等效平衡,按化学计量数转化到左边,必须满足n(N2):n(H2)=1:3,
①n(N2)=0,n(H2)=0,n(NH3)=4mol,按化学计量数转化到左边,必须满足n(N2):n(H2)=1:3,故正确;
②n(N2)=$\frac{1}{3}$mol,n(H2)=1mol,n(NH3)=0,满足n(N2):n(H2)=1:3,故正确;
③n(N2)=1mol,n(H2)=0,n(NH3)=2mol,按化学计量数转化到左边,不满足n(N2):n(H2)=1:3,故错误;
故选:①②.
点评 本题考查了等效平衡知识,题目难度中等,注意掌握判断等效平衡的方法:(1)恒温、恒容条件下:换算为方程式同一半边物质后,起始投料相同;完全等效(相同等效);(2)恒温、恒容条件下,若反应前、后气体体积相等:换算为方程式同一边物质后,起始投料符合同一比例;为不完全等效;(3)恒温、恒压条件下:换算为方程式同一边物质后,起始投料符合同一比例;百分数W%(体积分数、物质的量分数或质量分数)一定相同;为不完全等效.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案| A. | 铁 | B. | 碘 | C. | 铜 | D. | 镁 |
| 编号 | 实验 | 操作 |
| A | 实验室用自来水制备蒸馏水 | 将自来水倒入烧杯中,小心给烧杯加热 |
| B | 配制一定浓度的氯化钾溶液100mL | 将称好的氯化钾固体放入100mL容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 检验溶液中是否含SO42- | 先加入稀盐酸,无明显现象,再加入BaCl2溶液 |
| D | 取出分液漏斗中的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端管口放出 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 硫酸铁晶体 | B. | 浓硝酸 | C. | 硝酸锌晶体 | D. | 浓硫酸 |
| A. | 液态HCl不导电,所以AgCl不是电解质 | |
| B. | AgCl在水溶液中难导电,但熔融状态下能导电,所以AgCl是电解质 | |
| C. | 电解质一定能导电,能导电的物质一定属于电解质 | |
| D. | CO2溶于水形成的济液能导电,所以CO2是电解质 |
| A. | 常温时,BeCl2溶液的pH>7 | |
| B. | 常温时,Na2BeO2溶液的pH<7 | |
| C. | Be(OH)2既能溶于盐酸,又能溶于NaOH溶液 | |
| D. | BeCl2水溶液的导电性较强,说明BeCl2一定是离子化合物 |