题目内容
(12分)【化学——物质结构与性质】
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)和Fe(CO)x等。
①基态Fe3+的M层电子排布式为 ;
②尿素(H2NCONH2)分子中C原子的杂化方式是 ;
③配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。
Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。
(2)下列说法正确的是 (填字母序号)。
| A.第一电离能大小:S>P>Si |
| B.电负性顺序:C<N<O<F |
| C.因为晶格能CaO比KCl高,所以KCl的熔点比CaO熔点低 |
| D.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高 |
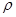 g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含
g·cm-3,阿伏加德罗常数为NA,求晶胞边长a= cm。(用含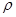 、NA的计算式表示)
、NA的计算式表示)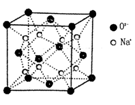
(1)①3s23p63d5;②sp2;③5;分子晶体。(2) BC。(3)立方体。 。
。
解析试题分析: (1)①铁为26号元素,根据构造理论知,基态Fe3+的M层电子排布式为3s23p63d5;②尿素(H2NCONH2)分子中C与3个原子成键,碳原子的杂化方式是sp2;③铁的价电子数为8,每个配体提供一个电子对,则8+2x=18,故x=5;Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于分子晶体。(2) A.同周期元素第一电离能由左向右逐渐增大,但P元素p轨道为半充满状态,性质稳定,故第一电离能大小:P>S>Si,错误;B.同周期元素电负性由左向右逐渐增大,电负性顺序:C<N<O<F,正确;C.离子晶体熔点的高低取决于晶格能大小,因为晶格能CaO比KCl高,所以KCl的熔点比CaO熔点低,正确;D.分子晶体熔化克服分子间作用力,与共价键键能大小无关,错误,选BC。(3)由题给氧化钠的晶胞结构知,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为立方体。由题给氧化钠的晶胞结构知,1个晶胞含有Na+:8个,O2-:8×1/8+6×1/3=4个,该晶胞质量=4×62/NAg,该晶胞的密度为ρ g?cm-3,则晶胞边长a=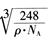 cm。
cm。
考点:考查物质结构与性质,涉及原子结构、原子间的成键方式、配合物、元素周期律及晶体结构、晶胞计算。

【化学——选修3:物质结构与性质】(15分)
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的_________区;溴的价电子排布式为____________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________。
| | 氟 | 氯 | 溴 | 碘 |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 |
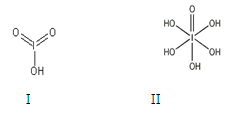
请比较二者酸性强弱:HIO3_____ H5IO6(填“>”、 “<”或“=”)。
(5)已知ClO2- 为角型,中心氯原子周围有四对价层电子。ClO2- 中心氯原子的杂化轨道类型为___________,写出一个ClO2- 的等电子体__________。
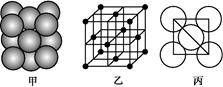
(6)下图为碘晶体晶胞结构。有关说法中正确的是_____________。
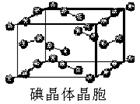
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
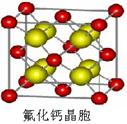
(7)已知CaF2晶体(见图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
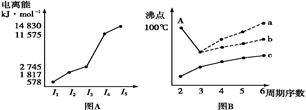
(15分)四种主族元素的性质或结构信息如下:
| 元素编号 | 相关信息 |
| X | 地壳中含量最大的金属元素;元素最高价为+3价。 |
| Y | 原子最外层电子数是电子层数的2倍,最外层电子数是X最外层电子数的2倍。 |
| Z | 同周期主族元素中原子半径最小,常温下单质呈液态。 |
| M | 能从海水中提取的金属元素,单质可在氮气或二氧化碳中燃烧。 |
(2)Y单质溶于热浓的硫酸产生的气体的化学式为 。
(3)能体现Z单质比Y单质活泼性强的一个化学方程式: 。
(4)常温下,不能与X的单质持续发生反应的是(填选项序号) 。
A.CuSO4溶液 B.Fe2O3 C.浓硫酸 D.NaOH溶液 E.Na2CO3固体
(5)铁元素与Z元素形成化合物FeZ3,FeZ3溶液按下图所示进行试验。装置通电后,连接电源 (填“正极”或“负极”)碳棒边的煤油颜色将变深,另一碳棒附近溶液将出现的现象是 。

下表为元素周期表的一部分,表中列出了11种元素在周期表中的位置,按要求完成下列各小题。
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑥ | | ⑦ | ⑨ | |
| 3 | ① | ③ | ⑤ | | | | ⑧ | ⑩ |
| 4 | ② | ④ | | | | | | |
(1)化学性质最不活泼的元素是 (填元素符号),其原子结构示意图为 。
(2)元素⑧的名称为 ,其最高价氧化物的水化物的化学式为 。
(3)元素③与元素⑧形成化合物的电子式为 。
(4)非金属性最强的元素是 (填元素符号)。除0族外原子半径最大的元素是 (填元素符号)。元素①单质与水反应的离子方程式是 。
(5)①、③、⑤三种元素的最高价氧化物水化物中,碱性最强的化合物的化学式是 。
(6)能形成两性氢氧化物的元素是 (用元素符号表示),写出该元素的单质与①的最高价氧化物的水化物反应的化学方程式 。
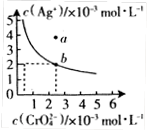
 的溶液中一定不存在Ag+
的溶液中一定不存在Ag+