题目内容
【化学–选修3:物质结构与性质】(15分)
X、Y、Z、W四种元素原子序数依次增大且均小于36。 Z基态原子最外层电子数是其内层电子总数的3倍,Y基态原子是同周期元素中未成对电子数最多的原子,X分别与Y、Z元素组合均可形成10电子微粒, W基态原子有10个价电子。回答下列问题(以下问题均以推知元素符号作答):
(1)若 YX3与X2Z﹑YX2-与ZX-﹑Y3-与Z2-性质相似,请写出Mg(YX2)2在一定条件下分解的化学反应方程式
⑵已知0℃时X2Z的密度为a g/cm3,其晶胞中X2Z分子的空间排列方式与金刚石晶胞类似,相似的原因是 。两个X2Z分子间的最近距离为 pm(用a和NA表示)。 已知X2Y的升华热是51 kJ/mol,除氢键外,X2Z分子间还存在范德华力(11 kJ/mol),则X2Z晶体中氢键的“键能”是 kJ/mol。
⑶ WZ是一种功能材料,已被广泛用于电池电极、催化剂、半导体、玻璃染色剂等方面。工业上常以W(YZ3)2·6X2Z和尿素[CO(NH2)2]为原料制备。
①W2+的基态核外电子排布式为 ,其核外电子有 种运动状态。
②尿素分子中碳原子的杂化方式为 ,1 mol尿素分子中含有的σ键数为 。
③YZ3-的空间构型 。
④WZ晶体的结构与NaCl相同,但天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种WZ晶体中就存在如图所示的缺陷:一个W2+空缺,另有两个W2+被两个W3+所取代。其结果晶体仍呈电中性,但化合物中W和Z的比值却发生了变化。经测定某样品中W3+与W2+的离子数之比为6∶91。若该晶体的化学式为WxZ,则x= 。
(15分)(1)3 Mg(NH2)2==Mg3N2+4NH3↑ (2分)
(2) 水中的O和金刚石中的C都是sp3杂化,且水分子间的氢键具有方向性,每个水分子可与相邻的4个水分子形成氢键(2分)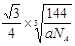 ×1010(2分) 20(1分)
×1010(2分) 20(1分)
(3)①1s22s22p63s23p63d8(2分) 26 (1分)
②sp2杂化(1分) 7NA(1分) ③平面三角(1分) ④0.97 (2分)
解析试题分析:Z基态原子最外层电子数是其内层电子总数的3倍,根据元素原子的最外层不超过8电子的排布规律判断,Z的内层只能是2个电子,最外层为6个电子,所以Z是O元素;Y基态原子是同周期元素中未成对电子数最多的原子,则Y是第二周期元素,其最外层的p轨道最多有3个未成对电子,所以Y是N元素;X分别与Y、Z元素组合均可形成10电子微粒, 水、氨气的分子中是10电子,所以X是H元素;W基态原子有10个价电子,则W是过渡元素,价层电子排布式为3d84s2,所以W是Ni元素。根据分析
(1)Mg(YX2)2相当于Mg(OH)2,分解生成MgO和H2O,所以Mg(YX2)2分解生成Mg3N2和4NH3,化学方程式为3 Mg(NH2)2==Mg3N2+4NH3↑;
(2)0℃时H2O为固态,水中的O和金刚石中的C都是sp3杂化,且水分子间能形成氢键,氢键具有方向性,每个水分子可与相邻的4个水分子形成氢键,所以冰的空间排列方式与金刚石晶胞类似;
两个X2Z分子间的最近距离的计算与金刚石中C与C原子的最近距离的计算相同,冰晶胞中共含8个水分子,2个水分子最近的距离是四面体的中心到顶点的距离,即为晶胞棱长的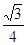 ,设晶胞棱长是bpm,则晶胞的密度a=8×18/NA/(b×10-10)3,b=
,设晶胞棱长是bpm,则晶胞的密度a=8×18/NA/(b×10-10)3,b=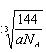 ×1010,所以两个X2Z分子间的最近距离为
×1010,所以两个X2Z分子间的最近距离为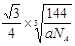 ×1010;冰的升华热是51kJ/mol,水分子间还存在范德华力(11kJ/mol),1mol水中含有2mol氢键,升华热=范德华力+氢键,所以冰晶体中氢键的“键能”是20kJ/mol;
×1010;冰的升华热是51kJ/mol,水分子间还存在范德华力(11kJ/mol),1mol水中含有2mol氢键,升华热=范德华力+氢键,所以冰晶体中氢键的“键能”是20kJ/mol;
(3)①Ni2+核外有26个电子,所以离子的核外电子排布式为1s22s22p63s23p63d8;有26个电子就有26种运动状态;
②尿素分子中碳原子周围有3个σ键,无孤对电子,所以是sp2杂化;尿素分子中除碳氧是双键外其余均是单键,双键中有1个是σ键,所以1 mol尿素分子中含有的σ键数为7NA;
③NO3-的价层电子对数=3+1/2(5+1-3×2)=3,所以NO3-的空间构型是平面正三角形;
④NiO中Ni的化合价为+2价,样品中W3+与W2+的离子数之比为6∶91,若该晶体的化学式为WxZ,根据晶体仍呈电中性,得6/97×x×3+91/97×x×2=2,解得x=0.97.
考点:考查元素推断,物质结构与性质的应用,晶胞的计算,化学式的判断,类推法的应用

 阅读快车系列答案
阅读快车系列答案(16分)X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16。在适当条件下三种单质两两化合,可发生如右图所示变化。己知l个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个。请回答下列问题: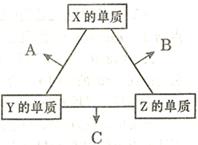
(1)由 X、Y、Z三种元素共同组成的三种不同种类的常见化合物的化学式为 ,相同浓度上述水溶液中由水电离出的c(H+)最小的是 (填写化学式)。
(2)Allis-Chalmers制造公司发现可以用C作为燃料电池的燃料,以氢氧化钾溶液为介质,反应生成对环境无污染的常见物质,试写出该电池负极的电极反应式 ,溶液中OH-向 极移动(填“正”或“负”)。
(3)Z分别与X、Y两元素可以构成18个电子分子甲和乙,其分子中只存在共价单键,常温下甲、乙均为无色液体,甲随着温度升高分解速率加快。
①乙能够将CuO还原为Cu2O,已知每lmol乙参加反应有4mole- 转移,该反应的化学方程式为 。
②将铜粉末用10%甲和3.0mol?L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol?L-1·min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
_____________________________________________________。
③实验室可用甲作试剂取X的单质,发生装置可选用下图中的 (填装置代号)。
(1)锂电池负极材料晶体为Li+嵌入两层石墨层中导致石墨堆积方式发生改变,上下层一样,形成如图晶体结构。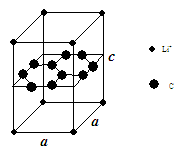
化学式为 ,该电池负极放电方程式为 。
Li+投影在石墨层图,试在图中标出与该离子邻近的其它六个Li+的投影位置。
Li+与相邻石墨六元环作用力属何种键型? 。
(2)石墨中键角为 ,C原子杂化方式为 ;实验测得石墨、苯和乙烯分子中C-C键键长依次为142、140、133 pm。请对上述系列中键长依次递减的现象作出合理的解释 。
(3)第ⅡA金属碳酸盐分解温度如下:
| | BeCO3 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 分解温度 | 100℃ | 540℃ | 960℃ | 1289℃ | 1360℃ |
写出BeCO3分解的化学方程式 。
分解温度为什么越来越高? 。
下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | | | | | | | |
| 二 | | | | ② | | ③ | ④ | |
| 三 | ⑤ | | ⑥ | ⑦ | ⑧ | | ⑨ | |
(1)在标号元素中,最活泼的金属元素是 。最活泼的非金属元素是 。⑨元素的离子结构示意图是 。
(2)①与②形成共价化合物的电子式 。用电子式表示⑤与⑨形成化合物的形成过程 。
(3)⑤、⑥、⑦三种元素的原子半径由大到小的顺序是 。
(4)⑦、⑧、⑨元素所形成的气态氢化物中,最稳定的是 。
⑦、⑧、⑨三种元素的最高价含氧酸的酸性由强到弱的顺序 。
(5)写出⑥元素的单质与盐酸反应的离子方程式: 。

 键的数目为 。
键的数目为 。
 的溶液中一定不存在Ag+
的溶液中一定不存在Ag+