题目内容
【题目】某学习小组按如图实验过程证明了海带中存在碘元素:下列说法不正确的是( )
A.步骤②中发生反应的离子方程式为2I-+2H++H2O2=I2+2H2O
B.步骤③操作后,观察到试管中的溶液变为蓝色,则可说明海带中含有碘元素
C.若步骤②仅滴加稀硫酸后通入氧气,则步骤③操作后,试管中的溶液也变成蓝色
D.步骤①需要将干海带放入蒸发皿中灼烧
【答案】D
【解析】
干海带灼烧,应放在坩埚内,过滤后所得滤液为含有I-的溶液;加入稀硫酸、H2O2混合溶液,发生氧化还原反应2I-+2H++H2O2=I2+2H2O,从而获得碘水,取少量放入试管,滴加淀粉溶液,溶液变蓝。
A.步骤②中,I-被H2O2氧化成I2,发生反应2I-+2H++H2O2=I2+2H2O,A正确;
B.步骤③操作后,溶液变蓝色,则表明烧杯内的溶液中含有I2,从而说明海带中含有碘元素,B正确;
C.若步骤②仅滴加稀硫酸后通入氧气,发生反应4I-+O2+4H+=2I2+2H2O,则步骤③操作后,溶液也变蓝色,C正确;
D.蒸发皿不能用于灼烧,灼烧必须使用坩埚,D不正确;
故选D。

 夺冠金卷全能练考系列答案
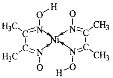
夺冠金卷全能练考系列答案【题目】氯化亚铜(![]() )常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含
)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含![]() 、
、![]() 、
、![]() 、
、![]() )生产
)生产![]() 的流程如图所示:
的流程如图所示:

根据以上信息回答下列问题:
(1)生产过程中:X是________,Z是________。(均填化学式)
(2)写出生成![]() 的离子方程式________。
的离子方程式________。
(3)析出的![]() 晶体不用水而用无水乙醇洗涤的原因是________。
晶体不用水而用无水乙醇洗涤的原因是________。
(4)在![]() 的生成过程中理论上不需要补充SO2气体,其理由是________。
的生成过程中理论上不需要补充SO2气体,其理由是________。
(5)已知:常温下![]() ,
,![]() ,现向
,现向![]() 饱和溶液中加入
饱和溶液中加入![]() 固体至
固体至![]() ,此时溶液中
,此时溶液中![]() =________。
=________。
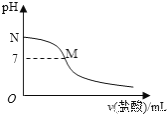
(6)实验探究pH对![]() 产率的影响如下表所示:
产率的影响如下表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出![]() 晶体最佳pH为________,当pH较大时
晶体最佳pH为________,当pH较大时![]() 产率变低的原因是________。
产率变低的原因是________。