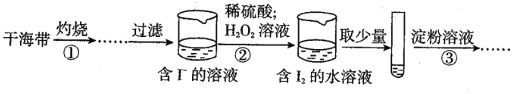
题目内容
【题目】氯化亚铜(![]() )常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含
)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含![]() 、
、![]() 、
、![]() 、
、![]() )生产
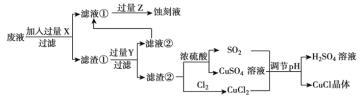
)生产![]() 的流程如图所示:
的流程如图所示:
根据以上信息回答下列问题:
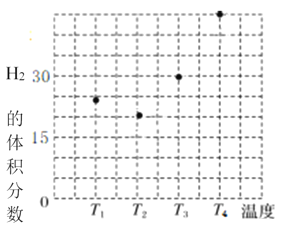
(1)生产过程中:X是________,Z是________。(均填化学式)
(2)写出生成![]() 的离子方程式________。
的离子方程式________。
(3)析出的![]() 晶体不用水而用无水乙醇洗涤的原因是________。
晶体不用水而用无水乙醇洗涤的原因是________。
(4)在![]() 的生成过程中理论上不需要补充SO2气体,其理由是________。
的生成过程中理论上不需要补充SO2气体,其理由是________。
(5)已知:常温下![]() ,
,![]() ,现向
,现向![]() 饱和溶液中加入
饱和溶液中加入![]() 固体至
固体至![]() ,此时溶液中
,此时溶液中![]() =________。
=________。
(6)实验探究pH对![]() 产率的影响如下表所示:
产率的影响如下表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出![]() 晶体最佳pH为________,当pH较大时
晶体最佳pH为________,当pH较大时![]() 产率变低的原因是________。
产率变低的原因是________。
【答案】Fe ![]() 或
或![]() 等合理答案亦可 2Cu2++SO2+2Cl-+2H2O=2CuCl↓+SO42-+4H+ 减少产品
等合理答案亦可 2Cu2++SO2+2Cl-+2H2O=2CuCl↓+SO42-+4H+ 减少产品![]() 的损失 Cu+2 H2SO4(浓)
的损失 Cu+2 H2SO4(浓) ![]() CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1∶1,CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2 H2SO4反应中消耗CuSO4和SO2也为1∶1,所以理论上不需要补充SO2气体
CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1∶1,CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2 H2SO4反应中消耗CuSO4和SO2也为1∶1,所以理论上不需要补充SO2气体 ![]() 2 pH较大时,
2 pH较大时,![]() 水解程度增大,反应生成
水解程度增大,反应生成![]() 减少
减少
【解析】
根据流程图,蚀刻液为氯化铁溶液,则滤液①为氯化亚铁,因此印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)中应先加入过量的铁粉除去铜离子和铁离子,过滤后,在滤液1中通入过量的氯气,可生成氯化铁,用于制作蚀刻液;滤渣①含有铜、铁,加入过量的盐酸除去铁,滤液②为氯化亚铁,滤渣②中含有铜,可与浓硫酸反应生成硫酸铜和二氧化硫,铜与氯气反应生成氯化铜,调节溶液pH,可生成硫酸和CuCl晶体,据此分析解答。
(1)由以上分析可知X是Fe,Z是Cl2,故答案为:Fe;Cl2;
(2)生成CuCl的离子方程式为2Cu2++SO2+2Cl-+2H2O=2CuCl↓+SO42-+4H+,故答案为:2Cu2++SO2+2Cl-+2H2O=2CuCl↓+SO42-+4H+;
(3) 氯化亚铜微溶于水、不溶于乙醇和稀硫酸,析出的CuCl晶体不用水而用无水乙醇洗涤,可减少产品CuCl的损失,同时乙醇易挥发,便于干燥,故答案为:减少产品CuCl的损失;
(4)依据图示可知:Cu+2 H2SO4(浓) ![]() CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1∶1,CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2 H2SO4反应中消耗CuSO4和SO2也为1∶1,所以理论上不需要补充SO2气体,故答案为:Cu+2 H2SO4(浓)
CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1∶1,CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2 H2SO4反应中消耗CuSO4和SO2也为1∶1,所以理论上不需要补充SO2气体,故答案为:Cu+2 H2SO4(浓) ![]() CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1∶1,CuCl2+CuSO4+SO2+2H2O = 2CuCl↓+2 H2SO4反应中消耗CuSO4和SO2也为1∶1,所以理论上不需要补充SO2气体;
CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1∶1,CuCl2+CuSO4+SO2+2H2O = 2CuCl↓+2 H2SO4反应中消耗CuSO4和SO2也为1∶1,所以理论上不需要补充SO2气体;
(5)常温下Ksp(CuCl)=1.6×10-7,Ksp(CuI)=1.2×10-12,现向CuCl饱和溶液中加入NaI固体至c(I-)=0.1molL-1,c(Cu2+)=![]() mol/L=1.2×10-11,c(Cl-)=
mol/L=1.2×10-11,c(Cl-)=![]() mol/L=4×10-4mol/L,此时溶液中
mol/L=4×10-4mol/L,此时溶液中![]() =
=![]() =3×10-8,故答案为:3×10-8;
=3×10-8,故答案为:3×10-8;
(6)由表中数据可知,析出CuCl晶体最佳pH为2,pH较大时,铜离子水解程度增大,反应生成CuCl减少,CuCl产率降低,故答案为:2;pH较大时,铜离子水解程度增大,反应生成CuCl减少。