��Ŀ����
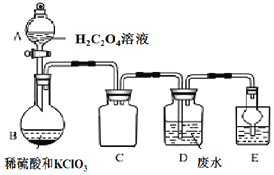
����Ŀ��ij��ҵ��ˮ�к��е� Mn2+��CN���Ȼ�Ի��������Ⱦ�����ŷ�֮ǰ������д�����ClO2��һ�ֹ����Ϲ��ϵİ�ȫ������ɫˮ��������ijʵ����ȤС��ͨ����ͼװ���Ʊ� ClO2����������������ҵ��ˮ�е� Mn2+��CN����
��֪��i��ClO2 Ϊ����ɫ���壬��������ˮ���е� 11�棻
ii��ClO2 �ױ�ը�����á��������塱��ϡ��ʱ����ը�����ͣ�
iii��ij��ҵ��ˮ���������� Mn2+ת��Ϊ MnO2��CN��ת��Ϊ�Դ�������Ⱦ�����壻
iv��װ�� B �з����ķ�ӦΪ��H2C2O4+H2SO4+2KClO3�TK2SO4+2CO2��+2ClO2��+2H2O��
��ش��������⣺
��1��B װ�õ�������_____��C װ�õ�����Ϊ_____��
��2���� H2C2O4 ��Һ��ϡ����� KC1O3 �Ʊ� ClO2 ������ŵ���_____��
��3��д��װ�� D �г�ȥ Mn2+�����ӷ���ʽ_____��
��4��ClO2 �ڴ�����ˮ�����п��ܻ�����������������Σ�ClO2 ���������Լ��У��ɽ� ClO2 ת��Ϊ Cl
����_____��������ĸ��ţ���
a��FeSO4 b��O3 c��KMnO4 d��SO2
��5����ʵ������Ը÷�ˮ��Ʒ�� CN���������вⶨ��ȡ��ҵ��ˮWg����ƿ�У�����10mL0.10mol/L ��������Һ���� 0.0200mol/L �� KMnO4����Һ���еζ������ﵽ�յ�ʱ������ KMnO4 ����Һ25.00mL��
�ڴ˹����У�
��ʵ����ʹ����ɫ�ζ��ܵ�ԭ����_____���ζ��յ���ж�������_____��
��W g ��ҵ��ˮ�� CN�������ʵ���Ϊ_____��
����ʢװ��ҵ��ˮ����ƿδ��ϴ����ⶨ�����_____���ƫ�ߡ�����ƫ�͡�����Ӱ�족����
���𰸡�Բ����ƿ ������ �Ƶ�ClO2��ͬʱ��CO2��������ϡ��ClO2����ͱ�ը�Ŀ����� 2ClO2+5Mn2++6H2O=5MnO2��+2Cl-+12H+ ad ��ֹKMnO4����ֽ� ��ƿ�е���Һ��ɫ����ɫ��Ϊ�Ϻ�ɫ���Ұ�����ڲ���ɫ 0.0005mol ��Ӱ��
��������
��1��BΪԲ����ƿ������Cװ�ý����ܡ������ܶ��϶̿�֪Ϊ��ȫƿ����ֹ������
��2����Ӧ���ɵIJ�����ClO2�ױ�ը���ö��������ϡ��ʱ���ɷ�ֹ��ը������
��3���������Ⱦ���ǿ�������ԣ��ܹ������������������ɶ������̣���������ԭΪ�����ӣ�
��4����ClO2 ת��Ϊ Cl-��Ӧ���뻹ԭ����
��5���ٸ�����ز��ȶ������������CN-����������ԭ��Ӧ������ԭΪ��ɫ�Ķ��������ӣ����Ե��ﵽ�ζ��յ�ʱ����ɫ����ɫ��Ϊ�Ϻ�ɫ���Ұ�����ڲ���ɫ��
���漰��ӦΪ��![]() ����Ϸ���ʽ���㣻
����Ϸ���ʽ���㣻
����ƿ������ϴ��
��1��Bװ�õ�������Բ����ƿ������Cװ�ý����ܡ������ܶ��϶̿�֪Ϊ��ȫƿ����ֹ�������ʴ�Ϊ��Բ����ƿ�� ��������
��2����H2C2O4��Һ��ϡ�����KClO3�Ʊ�ClO2��Ӧ����Ϊ�������ȡ�������̼��ϡ��ClO2����ͱ�ը�Ŀ����ԣ�
�ʴ�Ϊ���Ƶ�ClO2��ͬʱ��CO2��������ϡ��ClO2����ͱ�ը�Ŀ����ԣ�
��3���������Ⱦ���ǿ�������ԣ��ܹ������������������ɶ������̣���������ԭΪ�����ӣ����ӷ���ʽ��2ClO2+5Mn2++6H2O=5MnO2��+2Cl-+12H+��
�ʴ�Ϊ��2ClO2+5Mn2++6H2O=5MnO2��+2Cl-+12H+��
��4����ClO2 ת��Ϊ Cl-��Ӧ���뻹ԭ�����ɼ��������������������ȣ�
�ʴ�Ϊ��ad��
��5���ٸ�����ز��ȶ������ֽ⣬����Ӧ������ɫƿ�У����������CN-����������ԭ��Ӧ������ԭΪ��ɫ�Ķ��������ӣ����Ե��ﵽ�ζ��յ�ʱ����ɫ����ɫ��Ϊ�Ϻ�ɫ���Ұ�����ڲ���ɫ��
�ʴ�Ϊ����ֹKMnO4����ֽ⣻��ƿ�е���Һ��ɫ����ɫ��Ϊ�Ϻ�ɫ���Ұ�����ڲ���ɫ��
����CN-���ʵ���Ϊn�������ݷ���ʽ![]() ��֪��
��֪��
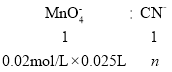
���n��0.0005mol��
�ʴ�Ϊ��0.0005mol��
����ƿ������ϴ���Բⶨ���û��Ӱ�죬
�ʴ�Ϊ����Ӱ�졣

 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д�