题目内容
13.下列化学用语正确的是( )| A. | 聚丙烯的链节:-CH2-CH2-CH2- | B. | 二氧化碳分子的比例模型: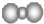 | ||
| C. | 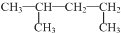 的名称:1,3-二甲基丁烷 的名称:1,3-二甲基丁烷 | D. | 氯离子的结构示意图: |
分析 A、加聚反应水断开双键依次连接形成的高分子化合物,其链节为:-CH2-CH(CH3)-;
B、C原子半径大于O原子,据此解答即可;
C、烷烃命名中不能出现1-甲基,据此解答即可;
D、氯离子核电荷数为17、核外电子数为18.
解答 解:A、聚丙烯的结构简式为: ,其链节为:-CH2-CH(CH3)-,故A错误;
,其链节为:-CH2-CH(CH3)-,故A错误;
B、二氧化碳是直线型分子,一个二氧化碳分子含一个碳原子两个氧原子,且C原子半径大于O原子,正确应为: ,故B错误;
,故B错误;
C、1号碳上出现甲基,说明不是选取的最长碳链,正确命名为:2-甲基戊烷,故C错误;
D、Cl-的离子的核电荷数为17,核外电子数为18,其结构示意图为 ,故D正确;故选D.
,故D正确;故选D.
点评 本题主要考查的是高聚物的链节、二氧化碳的比例模型、有机物命名、离子结构示意图等,综合性较强,难度不大.

练习册系列答案
相关题目
3.近年来我国很多城市发生严重的雾霾天气,对人们的健康造成严重威胁,下列有关环境问题的说法不正确的是( )
| A. | 改进汽车尾气净化技术,可以减少大气污染物的排放 | |
| B. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,与肺癌、哮喘等疾病的发生的发生密切相关,是雾霾天气的主要原因 | |
| C. | 推广燃煤脱硫技术可以降低SO2对大气的污染 | |
| D. | CO、SO2、NO、NO2都是对大气产生污染的气体,它们在空气中都能稳定存在 |
4.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是( )
| A. | 稀硝酸 | B. | 硝酸铜 | C. | 稀盐酸 | D. | 氢氧化钠 |
1.实验室可用浓盐酸与浓硫酸混合快速制取HCl.下列解释合理的是( )
| A. | 浓硫酸是高沸点的酸,通过它与浓盐酸反应制取低沸点的酸 | |
| B. | 通过改变温度和浓度等条件,利用平衡移动原理制取HCl | |
| C. | 两种强酸混合,溶解度会相互影响,低溶解度的物质析出 | |
| D. | 浓硫酸的浓度远大于浓盐酸的浓度,高浓度的酸制取低浓度的酸 |
18.用如图示的方法可以保护钢质闸门.下列说法正确的是( )


| A. | 当a、b间用导体连接时,则X应发生氧化反应 | |
| B. | 当a、b间用导体连接时,则X可以是锌或石墨 | |
| C. | 当a、b与外接电源相连时,a应连接电源的正极 | |
| D. | 当a、b与外接电源相连时,阴极的电极反应式:2Cl--2e→Cl2↑ |
5.2014年全国多个城市出现了严重的雾霾天气,十面“霾”伏,自强不“吸”等网络语流行,( )
| A. | 目前加碘食盐中主要添加的是KI | |
| B. | 光化学烟雾与大量排放碳氢化合物和氮氧化合物有关 | |
| C. | 淀粉、纤维素和聚乙烯都属于天然高分子化合物 | |
| D. | 光纤通信使用的光缆的主要成分和太阳能电池使用的材料都是SiO2 |
2.下列措施对增大化学反应速率明显增大的是( )
| A. | 使用催化剂 | B. | 增加压强 | C. | 增大反应物浓度 | D. | 升高温度 |
7.向一种溶液中滴加另一种溶液后,溶液的颜色不发生显著变化的是( )
| A. | 硝酸亚铁溶液中加入稀硫酸 | |
| B. | 含有酚酞的碳酸钠溶液中加入足量的氧化钙溶液 | |
| C. | 硫酸铜溶液中滴加硝酸钡溶液 | |
| D. | 高锰酸钾酸性溶液中滴加亚硫酸钠溶液 |

 ;其水溶液在空气中放置易变浑浊,写出反应的化学方程式2H2S+O2→2S↓+2H2O;该变化说明S的非金属性比O弱(填“强”或“弱”),从原子结构的角度解释原因:硫原子半径大于氧原子,硫原子的电子能力小于氧原子.通过H2O的稳定性大于H2S或SO2中硫是+4价,氧是-2价(举两例),也可以判断氧、硫两种元素的非金属性强弱.
;其水溶液在空气中放置易变浑浊,写出反应的化学方程式2H2S+O2→2S↓+2H2O;该变化说明S的非金属性比O弱(填“强”或“弱”),从原子结构的角度解释原因:硫原子半径大于氧原子,硫原子的电子能力小于氧原子.通过H2O的稳定性大于H2S或SO2中硫是+4价,氧是-2价(举两例),也可以判断氧、硫两种元素的非金属性强弱.