题目内容
向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。淀粉KI溶液中通入SO2气体,溶液无明显变化。则下列分析中正确的是
| A.白色沉淀是CuI2,棕色溶液含有I2 |
| B.滴加KI溶液时,转移2mol e- 时生成1mol白色沉淀 |
| C.通入SO2时,SO2与I—反应,I—作还原剂 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
D
解析试题分析:由题意可知发生的反应为:Cu2++3I-=CuI↓+I2,A、白色沉淀为CuI-,错误;B、生成2mol白色沉淀,错误;C、通入SO2气体,溶液无明显变化,故SO2与I-不反应,错误。
考点:考查氧化还原反应等相关知识。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案在下列变化中,按氮元素被还原、被氧化、既被氧化又被还原、既不被氧化又不被还原的顺序排列正确的是 ①大气通过闪电固氮 ②硝酸分解 ③实验室用氯化铵和消石制取氨气 ④二氧化氮溶于水中
| A.①②③④ | B.②④①③ | C.①③④② | D.②①④③ |
下列变化需要加入还原剂才能实现的
A.MnO4-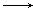 Mn2+ Mn2+ | B.HCl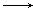 Cl2 Cl2 | C.Fe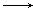 Fe3+ Fe3+ | D.KClO3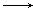 O2 O2 |
取一定质量的均匀固体混合物Cu、Cu2O和 CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为 ( )
| A.3.2mol/L | B.2.8mol/L | C.1.8mol/L | D.缺数据无法计算 |
已知向氯酸钠的酸性水溶液中通入二氧化硫气体,反应中SO2氧化过程为:SO2+2H2O –2e- =SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,反应中还原过程为:Cl2 + 2 e- =2Cl-。在上述两个反应中均会生成产物X,则X的化学式为( )
| A.ClO2 | B.NaClO4 | C.HClO | D.NaClO |
下列反应既属于氧化还原反应,又属于化合反应的的是
A.2Fe+3Cl2 2FeCl3 2FeCl3 | B.Fe2O3+3CO 2Fe+3CO2 2Fe+3CO2 |
| C.CaO+CO2=CaCO3 | D.H2SO4+2NaOH = Na2SO4+2H2O |
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O、NO+NO2+2NaOH=2NaNO2+H2O。则生成的盐溶液中NaNO3的物质的量为
| A.0.2 mol | B.0.4 mol | C.0.6 mol | D.0.8 mol |
NO2通过盛有水的洗气瓶,转移0.03mol电子时,参加反应的NO2气体在标准状况下的体积为
| A.224mL | B.336mL | C.448mL | D.672mL |
 的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )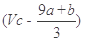 )mol
)mol