题目内容
一定量的CuS和Cu2S的混合物投人足量的硝酸中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量的NaOH溶液,产生蓝色沉淀,过滤,洗涤,灼烧,得到24.0 g CuO。若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为
| A.18.0 L | B.27.0 L | C.31.4L | D.33.6 L |
A
解析试题分析:若混合物全是CuS,其物质的量为0.3mol,电子转移数,0.3×(6+2)=2.4mol。两者体积相等,设NO xmol,NO2 xmol,3x+x=2.4,计算的x=0.6。气体体积V=1.2×22.4=26.88L;若混合物全是Cu2S,其物质的量为0.15mol,转移电子数0.15×10=1.5mol, 设NO xmol,NO2 xmol, 3x+x=1.5,计算得x=0.375,气体体积0.75×22.4=16.8L,收集到气体V L应该在两者之间,因此选A。
考点:本题考查了氧化还原反应计算(极限法)。

向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法正确的是( )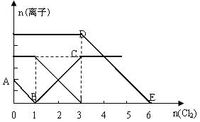
| A.还原性I->Fe2->Br- |
| B.原混合溶液中c(FeBr2) = 4mol/L |
| C.当通入Cl2 2mol时,溶液中已发生的离子反应可表示为:2Fe2+ + 2I- + 2Cl2 → 2Fe3+ + I2 + 4 Cl- |
| D.原溶液中n(Fe2+) :n(I-) :n(Br-) =" 2" :1 :3 |
吸入人体內的氧有2%转化为氧化性极强的“活性氧”,它能加速人体衰老,被称为“生命杀手”,服用含硒元素的化合物亚硒酸钠(Na2SeO3),能消除人体內的活性氧,由此推断Na2SeO3的作用是
| A.作还原剂 | B.作氧化剂 |
| C.既作氧化剂又作还原剂 | D.既不作氧化剂又不作还原剂 |
下列变化需要加入还原剂才能实现的
A.MnO4-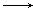 Mn2+ Mn2+ | B.HCl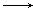 Cl2 Cl2 | C.Fe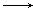 Fe3+ Fe3+ | D.KClO3 O2 O2 |
下列过程中不涉及氧化还原反应的是( )
| A.由植物油制备人造黄油 |
| B.用氯化铁溶液腐蚀印刷线路板 |
| C.用牺牲阳极的阴极保护法防止金属被腐蚀 |
| D.在蛋白质溶液中加入饱和硫酸铵溶液,析出白色固体 |
取一定质量的均匀固体混合物Cu、Cu2O和 CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为 ( )
| A.3.2mol/L | B.2.8mol/L | C.1.8mol/L | D.缺数据无法计算 |
已知向氯酸钠的酸性水溶液中通入二氧化硫气体,反应中SO2氧化过程为:SO2+2H2O –2e- =SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,反应中还原过程为:Cl2 + 2 e- =2Cl-。在上述两个反应中均会生成产物X,则X的化学式为( )
| A.ClO2 | B.NaClO4 | C.HClO | D.NaClO |
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O、NO+NO2+2NaOH=2NaNO2+H2O。则生成的盐溶液中NaNO3的物质的量为
| A.0.2 mol | B.0.4 mol | C.0.6 mol | D.0.8 mol |
在实验室中,常用KMnO4代替MnO2与浓盐酸反应制取氯气,其反应的化学方程式为
2KMnO4+16HCl(浓)= 2MnCl2+5Cl2↑+2KCl+8H2O,下列叙述中正确的是( )
| A.反应中KMnO4被氧化 |
| B.氧化产物与还原产物的物质的量之比为2﹕5 |
| C.每生成1 mol Cl2时,反应中转移的电子为2 mol |
| D.每消耗16 mol HCl时,其中做氧化剂的HCl是10 mol |