题目内容
在xR2++yH++O2= mR3++nH2O的离子方程式中,对系数m和R3+的判断正确的是( )
| A.m="4" R2+是氧化产物 | B.m="y" R3+是氧化产物 |
| C.m="2" R3+是还原产物 | D.m="y" R3+是还原产物 |
B
解析试题分析:在氧化还原反应类型的离子方程式中要遵循电荷守恒、原子守恒和得失电子数目相等。在xR2++yH++O2= mR3++nH2O的离子方程式中,根据氧原子守恒,n=2,根据氢原子守恒,y=4,根据R原子守恒则x=m,根据电荷守恒则2x+y=3m,所以x=y=m=4,在反应中,R的化合价由+2价升高+3价,R3+是氧化产物,氧元素化合价由0价降低-2价,H2O是还原产物,选B。
考点:考查离子方程式配平及氧化还原反应基本概念。

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案已知向氯酸钠的酸性水溶液中通入二氧化硫气体,反应中SO2氧化过程为:SO2+2H2O –2e- =SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,反应中还原过程为:Cl2 + 2 e- =2Cl-。在上述两个反应中均会生成产物X,则X的化学式为( )
| A.ClO2 | B.NaClO4 | C.HClO | D.NaClO |
水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+4OH-=Y+S4O62-+2H2O,下列有关说法正确的是
| A.Y的化学式为Fe2O3 |
| B.S4O62- 是还原产物 |
| C.被1mol O2氧化的Fe2+物质的量为1 mol |
| D.每 32 gO2参加反应,转移电子的物质的量为4 mol |
在实验室中,常用KMnO4代替MnO2与浓盐酸反应制取氯气,其反应的化学方程式为
2KMnO4+16HCl(浓)= 2MnCl2+5Cl2↑+2KCl+8H2O,下列叙述中正确的是( )
| A.反应中KMnO4被氧化 |
| B.氧化产物与还原产物的物质的量之比为2﹕5 |
| C.每生成1 mol Cl2时,反应中转移的电子为2 mol |
| D.每消耗16 mol HCl时,其中做氧化剂的HCl是10 mol |
下列反应中,铁元素被氧化的是( )
| A.FeS +2HCl = FeCl2 + H2S↑ | B.Fe +H2SO4 = FeSO4 +H2↑ |
| C.FeO + 2HCl =FeCl2 +H2O | D.2FeCl3 +Cu = 2FeCl2 + CuCl2 |
a mol FeS与b mol FeO投入到VL、c mol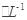 的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)x63g ②(a+b)x189g ③(a+b)mol ④(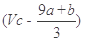 )mol
)mol
| A.①④ | B.②③ | C.①③ | D.②④ |
在反应KClO3+6HCl=KCl+3Cl2+3H2O中,被还原和被氧化的氯原子的质量比为
| A.1 :6 | B.6 :1 | C.1 :5 | D.5 :1 |
臭氧可使湿润的淀粉KI试纸变蓝,化学方程式为2KI+O3+H2O=2KOH+I2+O2。下列叙述中正确的是( )
| A.在反应中水被氧化成氧气 | B.该反应中水是氧化剂 |
| C.每生成1 mol I2,转移的电子数为1 mol | D.反应中氧化剂与还原剂的物质的量之比为1∶2 |
工业上以CuFeS2为原料冶炼铜的主要反应为①2CuFeS2+4O2 Cu2S+3SO2+ 2FeO(炉渣);②2Cu2S+3O2
Cu2S+3SO2+ 2FeO(炉渣);②2Cu2S+3O2 2Cu2O+2SO2;③2Cu2O+Cu2S
2Cu2O+2SO2;③2Cu2O+Cu2S Cu+SO2↑。下列说法错误的是
Cu+SO2↑。下列说法错误的是
| A.由1 mol CuFeS2生成1mol Cu,共消耗2.75 molO2 |
| B.该冶炼方法中产生大量的有害气体SO2,可回收用于制备硫酸 |
| C.在反应③中,Cu2S既是氧化剂,又是还原剂 |
| D.在反应①中,SO2既是氧化产物,又是还原产物 |