题目内容
下列选项合理的是 ( )
A.pH皆等于3 的两种溶液都稀释100倍后,pH都为5
B.10mL 0.02mol/L HCl溶液与10mL 0.02mol/L Ba(OH) 2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7
C.在0.1mol/L某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
D.室温下,在一定量稀氨水中逐滴滴入稀盐酸,对于所得溶液中离子浓度大小关系
可能是:c(NH4+)>c(Cl—)>c(OH—)>c(H+)
D
解析试题分析:A.pH等于3的强酸溶液稀释100倍后,pH为5;pH=3的弱酸或强酸弱碱盐溶液稀释100倍后,pH小于5。错误。B。n(H+)="0.01L×0.02mol/L=0.002mol;" n(OH-)=0.01L×0.02mol/L×2=0.004mol.所以混合后,OH-的物质的量多,溶液显碱性。PH>7.错误。C.在0.1mol/L某二元弱酸强碱盐NaHA溶液中,根据物料守恒可得:c(Na+)=c(A2-)+c(HA-)+c(H2A)。错误。D.室温下,在一定量稀氨水中逐滴滴入稀盐酸,若滴加的HCl不足量氨水过量,溶液显碱性,则存在离子浓度大小关系可能是:c(NH4+)>c(Cl—)>c(OH—)>c(H+)。正确。
考点:考查关于溶液的酸碱性及离子浓度的大小比较的知识。

草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/LNaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH)=0时,c(H+)=1×10-2mol/L |
| B.V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| C.V(NaOH)=10mL时,c(H+)=1×10-7mol/L |
| D.V(NaOH)>10mL时,c(Na+)>c(C2O42-)>c(HC2O4-) |
常温下,向l00mL 0.01 mol?L-1盐酸中逐滴加入0.02 mol?L-1 MOH溶液,如下图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是( )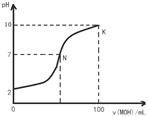
| A.MOH是弱碱 |
| B.N点c(Cl-) = c(M+) |
C.随着MOH溶液的滴加,比值 不变 不变 |
| D.K点对应的溶液c(MOH)+c(OH-)-c(H+) = 0.005 mol?L-1 |
用食用白醋(醋酸浓度约为1 mol/L)进行下列实验,能证明醋酸为弱电解质的是
| A.白醋中滴入石蕊试液呈红色 | B.白醋加入豆浆中有沉淀产生 |
| C.蛋壳浸泡在白醋中有气体放出 | D.pH试纸显示醋酸的pH为2~3 |
粗制的CuSO4·5H2O晶体中含有Fe2+。提纯时,为了除去Fe2+,常加入少量H2O2, 然后再加入少量碱至溶液pH=4,可以达到除去铁离子而不损失硫酸铜的目的。下列说法不正确的是
| A.溶解CuSO4·5H2O晶体时要加入少量稀H2SO4 |
| B.加入H2O2,将Fe2+氧化,2Fe2+ + H2O2 + 2H+ ="=" 2Fe3+ + 2H2O |
| C.由于CuSO4的催化作用,会使部分H2O2分解而损失 |
| D.调溶液pH=4的依据是Cu(OH)2比Fe(OH)3更难溶 |
下列叙述中,不正确的是
| A.pH=2与pH=1的CH3COOH溶液中,c(H+)之比为1 :10 |
| B.1.0mol/ L的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| C.仅含Na+、H+、OH-、CH3COO-离子的某溶液中可能存在: c(Na+)>c(CH3COO-) >c(OH-)>c(H+) |
| D.0.1mol/ L的CH3COOH溶液中,由水电离出的c(H+)为1×10-13mol/ L |
下列措施不合理的是
| A.用SO2漂白纸浆和草帽辫 |
| B.用硫酸清洗锅炉中的水垢 |
| C.高温下用焦炭还原SiO2制取粗硅 |
| D.用 Na2S作沉淀剂,除去废水中的Cu2+和Hg2+ |
下列实验步骤与实验事实的相应结论解释正确的是
| 选项 | 实验步骤与实验事实 | 结论解释 |
| A | Mg(OH)2、Al(OH)3混合物中加入NaOH溶液,Al(OH)3溶解而Mg(OH)2没有溶解 | Mg(OH)2Ksp比Al(OH)3的小 |
| B | ZnS能溶解在稀盐酸中,CuS不能溶解在稀盐酸中 | CuS的Ksp比ZnS的小 |
| C | 在溶有NH3的BaCl2溶液中通入CO2,有白色沉淀生成 | NH3在反应中作催化剂 |
| D | 单质硅不溶于浓硫酸和浓硝酸 | 硅被强氧化性酸钝化 |