题目内容
下列溶液中有关物质的量浓度关系正确的是( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合: c(H+) + c(M+) ="=" c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合: c(CH3COO-) +c(OH-) ==c(H+) + c(CH3COOH)
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
A
解析试题分析:A符合电荷守恒的原则。正确。B.当溶液的浓度相等时碱的电量大于盐的水解。而且形成盐的酸的酸性越弱,盐水解的程度就越大。因此pH相等的CH3COONa、NaOH和Na2CO3三种溶液物质的浓度关系是c(NaOH)<c(Na2CO3) <c(CH3COONa)。错误。C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,由于CH3COOH的电离大于CH3COO-的水解程度,所以溶液显酸性。根据电荷守恒可得c(CH3COO-) +c(OH-) ==c(H+) + c(Na+);根据物料守恒可得c(CH3COO-) + c(CH3COOH) =2c(Na+)。两式联立可得c(CH3COO-) +2c(OH-) ==2c(H+) + c(CH3COOH).错误。D.0.1mol·L-1的NaHA溶液,其pH=4,说明HA-的电离作用大于其水解作用。但是无论的电离还是水解程度都是很微弱的。溶液中主要还是以盐的离子形式存在。在溶液中除了HA-的电离还存在水的电离作用,因此c(H+)>c(A2-)。故c(HA-)>c(H+)>c(A2-)>c(H2A)。错误。
考点:考查盐的电离和水解平衡、离子浓度的大小比较及物质浓度的关系的知识。、

下列说法正确的是
| A.向AgCl悬浊液中加入少量NaCl固体后振荡,c(Cl-)增大,KsP (AgCl)增大 |
B.某溶液中由水电离出的 时,则该溶液的pH一定为14-a 时,则该溶液的pH一定为14-a |
| C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后溶液的pH等于7,则混合溶液 中: 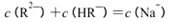 |
D.相同物质的量浓度的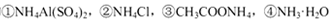 溶液中,c (NH4+)由大到小的顺序是:①>②>③>④ 溶液中,c (NH4+)由大到小的顺序是:①>②>③>④ |
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是( )
A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO 和OH- 和OH- |
| B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-) |
| C.10 mL0.20mol·L-1CH3COOH溶液加入10 mL0.10mol·L-1的NaOH后,溶液中:c(CH3COO-)+c(CH3COOH)= 0.10mol·L-1 |
| D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
关于常温下pH=2的醋酸溶液,下列叙述正确的是
| A.c(CH3COOH)=0.01mol·L-1 |
| B.c(H+)=c(CH3COO-) |
| C.加水稀释100倍后,溶液pH=4 |
| D.醋酸的电离常数为Ka,CH3COO-的水解常数为Kh,则Ka·Kh=Kw |
常温下,pH=12的氢氧化钠溶液pH=4的醋酸溶液等体积混合后恰好中和,忽略混合后溶液体积的变化,下列说法中正确的是
| A.混合前的醋酸约1%发生电离 |
| B.混合后的溶液中c(Na+)<c(CH3COO-) |
| C.氢氧化钠和醋酸和浓度不相等 |
| D.混合后的溶液呈中性 |
250C时,pH=3的HNO3,下列该硝酸说法正确的是
| A.该硝酸中水电离出的c(H+)=1.0×10-3mol/L |
| B.加水稀释到原溶液体积的100倍,硝酸溶液的pH为5 |
| C.相同温度下,pH=3的CH3COOH溶液的物质的量浓度与该硝酸相同 |
| D.该硝酸中加入少量的Zn粒产生H2 |
对滴有酚酞试液的下列溶液,操作后颜色变深的是
| A.明矾溶液加热 | B.CH3COONa溶液加热 |
| C.氨水中加入少量NH4Cl | D.小苏打溶液中加入少量的NaCl固体 |
室温下,将1.000 mol·L-1盐酸滴入20.00 mL1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )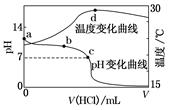
| A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1 |
| B.b点:c(NH4+)+c(NH3·H2O)=c(Cl-) |
| C.c点:c(Cl-)=c(NH4+) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |