题目内容
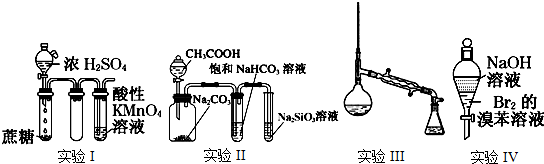
3.下列实验操作不能达到实验目的是( )①用氢氧化钠溶液除去乙酸乙酯中混有的乙酸等杂质
②用分液漏斗分离乙醇和乙酸乙酯
③用乙醇和3%的硫酸共热到170℃制乙烯
④用加入浓溴水的方法分离苯和苯酚的混合物.
| A. | ①②③④ | B. | ①②③ | C. | ②③ | D. | ①④ |
分析 ①乙酸乙酯在NaOH溶液中水解;
②乙醇和乙酸乙酯能互溶;
③用乙醇和浓硫酸共热到170℃制取乙烯;
④生成三溴苯酚溶于苯中.
解答 解:①乙酸乙酯在NaOH溶液中水解,不能除杂,应选饱和碳酸钠液除去乙酸乙酯中混有的乙酸和乙醇,故①错误;
②乙醇和乙酸乙酯能互溶,不分层,故②错误;
③用乙醇和浓硫酸共热到170℃制取乙烯,不能用稀硫酸,故③错误;
④生成三溴苯酚溶于苯中,应用氢氧化钠溶液,然后分液分离,故④错误;
故选A.
点评 本题考查物质的除杂、混合物的分离提纯,明确物质的性质及常见混合物的分离方法是解答本题的关键,综合性较强,题目难度不大.

练习册系列答案
相关题目
13.下列四个实验中,结论正确的是( )
| A. | 有一澄清的碱性溶液,做离子鉴定时得出的结论是含有:Al(OH)4-、Fe3+、HCO3- | |
| B. | 某一固体溶于水后,检验出含有K+、NO3-、Na+、Cl-等离子,则该固体混合物是KNO3和NaCl的混合物或KCl和NaNO3的混合物 | |
| C. | 固体NaOH吸收了空气中的二氧化碳并溶于水后,则溶液中就一定大量存在碳酸根离子 | |
| D. | 加热碳酸氢铵固体,将生成的气体通过碱石灰能制备NH3 |
14.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 澄清透明的溶液中:K+、SO42-、Cu2+、Cl- | |
| B. | 0.1mol/L 的FeCl2的溶液中:H+、Na+、NO3-、Cl- | |
| C. | 使甲基橙变红的溶液中:K+、HCO3-、Ba2+、I- | |
| D. | c(H+)/c(OH-)=1×10-12:NH4+、Cl-、Ca2+、Br- |
11.现有5种基团:-CH3、-OH、-CHO、-COOH、-C6H5,对由其中两两基团构成且显酸性的有关物质叙述正确的是( )
| A. | 共有4种,其中一种物质不属于羧酸 | |
| B. | 共有5种,其中一种为二元酸 | |
| C. | 共有6种,其中只有一种不是有机酸 | |
| D. | 共有6种,它们在一定条件下均能与乙醇发生酯化反应 |
1.某温度下,碳和H2O(g)在密闭容器里发生下列反应:①C(s)+H2O(g)?CO(g)+H2(g),②CO(g)+H2O(g)?CO2(g)+H2(g)当反应达到平衡时,c(H2)=1.9mol•L-1、c(CO)=0.1mol•L-1.则下列叙述正确的是( )
| A. | CO在平衡时转化率为10% | |
| B. | 平衡浓度c(CO2)=c(H2) | |
| C. | 其他条件不变时,缩小体积,反应②平衡不移动 | |
| D. | 平衡时增大碳的质量,反应①中热量值不变 |
5.银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故.根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器漫入该溶液中,一段时间后发现黑色会褪去.下列说法正确的是( )
| A. | 处理过程中银器一直保持恒重 | |
| B. | 食盐溶液作为电解质溶液形成原电池 | |
| C. | 银器为正极,Ag2S被还原生成单质银 | |
| D. | 黑色褪去的原因是黑色Ag2S转化为白色AgCl |
6.正确掌握化学基本概念和化学用语是学好化学的基础,下列有关表述中正确的是( )
| A. | 过氧化氢与过氧化钠中含有化学键的类型完全相同 | |
| B. | NaHSO4在水溶液中的电离方程式为:NaHSO4═Na++H++SO42- | |
| C. | 因为NH4HCO3是强电解质,所以在其水溶液中只存在水解平衡,不存在电离平衡 | |
| D. | H216O、D216O、H218O、D218O互为同素异形体 |
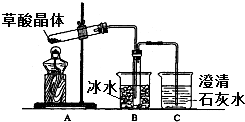 草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5.草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水.草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解.回答下列问题:
草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5.草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水.草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解.回答下列问题: