题目内容
1.某温度下,碳和H2O(g)在密闭容器里发生下列反应:①C(s)+H2O(g)?CO(g)+H2(g),②CO(g)+H2O(g)?CO2(g)+H2(g)当反应达到平衡时,c(H2)=1.9mol•L-1、c(CO)=0.1mol•L-1.则下列叙述正确的是( )| A. | CO在平衡时转化率为10% | |
| B. | 平衡浓度c(CO2)=c(H2) | |
| C. | 其他条件不变时,缩小体积,反应②平衡不移动 | |
| D. | 平衡时增大碳的质量,反应①中热量值不变 |
分析 碳与水反应生成的氢气的浓度为amol/L,则生成的CO为amol/L,令CO与水反应生成氢气的浓度为bmol/L,则生成的二氧化碳的浓度为bmol/L,消耗的CO浓度为bmol/L,平衡时氢气的浓度为1.9mol/L,则amol/L+bmol/L=1.9mol/L,平衡时CO的浓度为0.1mol/L,则amol/L-bmol/L=0.1mol/L,联立解得a=1,b=0.9,据此判断各选项.
解答 解:A.碳与水反应生成的CO浓度为1mol/L,剩余0.1mol/L,则转化率为$\frac{1-0.1}{1}$×100%=90%,故A错误;
B.平衡时,平衡时CO2的浓度等于CO消耗的浓度,即c(CO2)=1mol/L-0.1mol/L=0.9mol/L,c(H2)=1.9mol•L-1,二者不等,故B错误;
C.缩小体积,压强增大,反应前后气体计量数之和相同,化学平衡不移动,故C正确;
D.C为纯固体,增大C的质量,平衡不移动,即反应①中热量值不变,故D正确;
故选CD.
点评 本题考查化学平衡移动、计算,难度不大,应学会化学平衡的计算方式.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列离子组能在溶液中大量共存的是( )
| A. | Fe2+、H+、Na+、NO3- | B. | SiO32-、K+、Br-、H+ | ||
| C. | NH4+、Cl-、Mg2+、SO42- | D. | Na+、OH-、NH4+、I- |
16.以下各组物质间的每步转化,存在不能通过一步反应实现的是( )
| A. | SO2→H2SO4→MgSO4→BaSO4 | B. | Si→SiO2→H2SiO3→Na2SiO3 | ||
| C. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 | D. | Na→Na2SO4→NaOH→Na2CO3 |
3.下列实验操作不能达到实验目的是( )
①用氢氧化钠溶液除去乙酸乙酯中混有的乙酸等杂质
②用分液漏斗分离乙醇和乙酸乙酯
③用乙醇和3%的硫酸共热到170℃制乙烯
④用加入浓溴水的方法分离苯和苯酚的混合物.
①用氢氧化钠溶液除去乙酸乙酯中混有的乙酸等杂质
②用分液漏斗分离乙醇和乙酸乙酯
③用乙醇和3%的硫酸共热到170℃制乙烯
④用加入浓溴水的方法分离苯和苯酚的混合物.
| A. | ①②③④ | B. | ①②③ | C. | ②③ | D. | ①④ |
10.胡椒酚是植物挥发油中的一种成分,结构简式如图,关于胡椒酚的下列说法正确的是( )
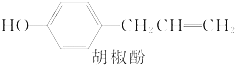

| A. | 该化合物属于芳香烃 | |
| B. | 该化合物的分子式是 C9H11O | |
| C. | 分子中所有碳原子一定处于同一平面 | |
| D. | 1 mol该化合物最多可与4 mol H2发生反应 |
 .
. →
→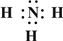 ,B的结构式
,B的结构式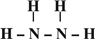
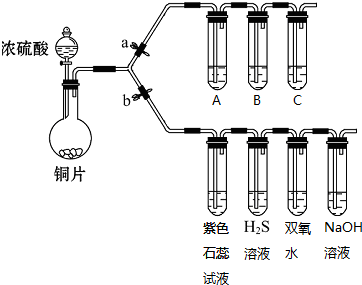
 .
.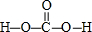 .
.