题目内容
8.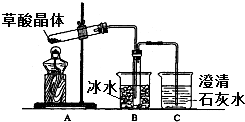 草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5.草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水.草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解.回答下列问题:
草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5.草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水.草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解.回答下列问题:(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物.装置C中可观察到的现象是有气泡逸出、澄清石灰水变浑浊,由此可知草酸晶体分解的产物中有CO2.装置B的主要作用是冷凝草酸、水蒸气等,
防止草酸进入装置C反应生成沉淀,干扰CO2的检验.
(2)设计实验证明:草酸为二元酸.滴定剂(已知浓度的标准溶液):氢氧化钠溶液,指示剂:酚酞.
滴定终点的现象是:无色变到粉红色(或淡红色)且半分钟内颜色不变.配制准确浓度的草酸溶液需要用到的主要玻璃仪器有:烧杯、玻璃棒、容量瓶、胶头滴管.
(3)乙同学另外做了一个酸碱反应的实验.常温下取pH=13的氢氧化钡溶液和浓度为c 的盐酸等体积混合后测得溶液的pH=12,则盐酸的浓度c=0.08mol/L.(忽略溶液混合过程中体积发生的变化)
分析 (1)草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解,如果草酸受热分解,分解时会产生二氧化碳而使澄清石灰水变浑浊;草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水,B装置温度较低,有冷凝作用,防止干扰实验;
(2)要证明醋酸为二元弱酸,需要用强碱溶液滴定,可以选用氢氧化钠溶液,滴定终点时溶液呈碱性,可以选用酚酞作指示剂;滴定结束溶液为无色,滴定结束时溶液为粉红色,据此判断滴定终点;根据配制一定物质的量浓度的溶液步骤判断使用的玻璃仪器;
(3)pH=13的氢氧化钠溶液的浓度为0.1mol/L,pH=12的溶液中氢氧根离子浓度为0.01mol/L,设溶液体积为VL,根据酸碱反应实质列式计算出盐酸的浓度c.
解答 解:(1)草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解,如果草酸受热分解,分解时会产生二氧化碳,二氧化碳和氢氧化钙反应生成难溶性的碳酸钙沉淀而使澄清石灰水变浑浊,所以C中观察到的现象是:有气泡冒出且澄清石灰水变浑浊,说明有二氧化碳生成;
草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水,草酸易挥发,导致生成的气体中含有草酸,草酸和氢氧化钙反应生成难溶性的草酸钙而干扰二氧化碳的检验,B装置温度较低,有冷凝作用,防止干扰二氧化碳的检验,
故答案为:有气泡冒出,澄清石灰水变浑浊;CO2;冷凝(水蒸气和草酸),防止草酸进入装置C反应生成沉淀而干扰CO2的检验;
(2)设计实验证明草酸为二元酸,需要选用氢氧化钠溶液作滴定剂,草酸钠溶液呈碱性,可以选用酚酞作指示剂;滴定结束前溶液呈无色,滴定结束时溶液变为粉红色,则滴定终点的现象为:无色变到粉红色(或淡红色)且半分钟内颜色不变;根据配制草酸溶液的步骤可知,配制过程中需要用到的主要玻璃仪器有:烧杯、玻璃棒、容量瓶、胶头滴管,
故答案为:氢氧化钠溶液;酚酞;无色变到粉红色(或淡红色)且半分钟内颜色不变;烧杯、玻璃棒、容量瓶、胶头滴管;
(3)pH=13的氢氧化钠溶液的浓度为0.1mol/L,pH=12的溶液中氢氧根离子浓度为0.01mol/L,
设溶液体积为VL,则:$\frac{0.1mol/L×VL-cmol/L×VL}{2VL}$=0.01mol/L,
解得:c=0.08mol/L,
故答案为:0.08.
点评 本题考查了草酸性质方案设计、中和滴定操作方法、酸碱混合的定性判断及计算等知识,题目难度中等,注意掌握化学实验基本操作方法,明确中和滴定操作方法及酸碱混合的定性判断及计算方法.

| A. | 汽油 | B. | C2H6O | C. | 聚乙烯 | D. | 甘油 |
| A. | 除去乙烷中少量的乙烯:光照条件下通入Cl2,使乙烯转化成液态二氯乙烷而与乙烷分离 | |
| B. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 | |
| D. | 除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤,分液、干燥、蒸馏 |
①用氢氧化钠溶液除去乙酸乙酯中混有的乙酸等杂质
②用分液漏斗分离乙醇和乙酸乙酯
③用乙醇和3%的硫酸共热到170℃制乙烯
④用加入浓溴水的方法分离苯和苯酚的混合物.
| A. | ①②③④ | B. | ①②③ | C. | ②③ | D. | ①④ |
| 名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
| 结构式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH | (CH3O)2CO |
| 沸点(℃) | 64.7 | 7.4 | 153℃ | -24.9 | 90℃ |
(2)甲醇合成二甲基甲酰胺的化学方程式为:2CH3OH+NH3+CO?(CH3)2NCHO+2H2O△H若该反应在常温下能自发进行,则△H<0 (填“>”、“<”或“=“).
(3)甲醇制甲醚的化学方程式为:2CH3OH?CH3OCH3+H2O△H.一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生该反应.
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
②已知387℃时该反应的化学平衡常数K=4.若起始时向容器I中充入0.1mol CH3OH、
0,.15mol CH3OCH3和0.10mol H2O,则反应将向正(填“正”或“逆”)反应方向进行.
③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的措施为降温.
(4)以甲醇为主要原料,电化学合成碳酸二甲酯工作原理如图所示.
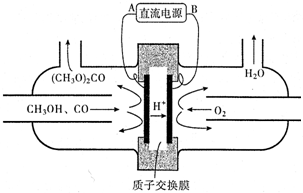
电源负极为B(填“A”或“B“),写出阳极的电极反应式2CH3OH+CO-2e-=(CH3O)2CO+2H+.
若参加反应的O2为1.12m3(标准状况),则制得碳酸二甲酯的质量为9.00kg.
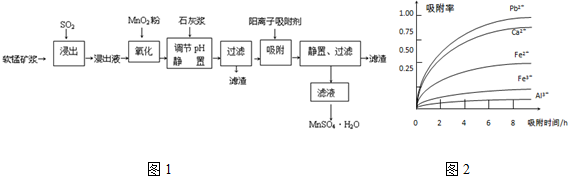
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子.PbO2的氧化性大于MnO2.有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见图2.
| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
(2)Fe2+被氧化的过程中主要反应的离子方程式2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至4.7≤pH<8.3范围.
(4)阳离子吸附剂可用于除去杂质金属离子.请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子半径、金属离子电荷等(写二点).
(5)吸附步骤除去的主要离子为Pb2+、Ca2+.
(6)电解MnSO4、ZnSO4和H4SO4的混合溶液可制备MnO2和Zn,写出阳极的电极反应方程式Mn2+-2e-+2H2O=MnO2↓+4H+.
| A. | 分离汽油和煤油 | B. | 将重油分离为润滑油等 | ||
| C. | 将直链烃变为芳香烃 | D. | 十六烷变为辛烷和辛烯 |
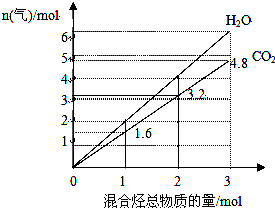 由两种气态烃组成的混合物的总物质的量与该混合物充分燃烧后所得气体产物(二氧化碳和水蒸气)的物质的量的变化关系如图所示,则以下对其组成的判断不正确的是( )
由两种气态烃组成的混合物的总物质的量与该混合物充分燃烧后所得气体产物(二氧化碳和水蒸气)的物质的量的变化关系如图所示,则以下对其组成的判断不正确的是( )| A. | 一定有乙烯 | B. | 一定有甲烷 | C. | 一定没有丙烷 | D. | 一定没有丙烯 |