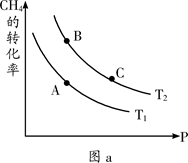
题目内容
氢氧两种元素形成的常见物质有H2O与H2O2,在一定条件下均可分解。
(1)已知:
| 化学键 | 断开1mol化学键所需的能量(kJ) |
| H—H | 436 |
| O—H | 463 |
| O=O | 498 |
②H2O(g)分解的热化学方程式是 。
③11.2 L(标准状况)的H2完全燃烧,生成气态水,放出 kJ的热量。
(2)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响。常温下,按照如表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 | |
| a | 50 mL 5% H2O2溶液 | | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| b | 50 mL 5% H2O2溶液 | 少量浓盐酸 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| c | 50 mL 5% H2O2溶液 | 少量浓NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| d | 50 mL 5% H2O2溶液 | | MnO2 |
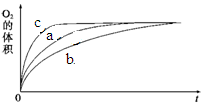
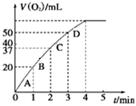
图1 图2
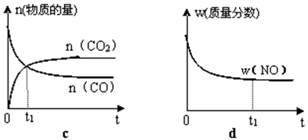
由该图能够得出的实验结论是_________。
②测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示。解释反应速率变化的原因: 。
(1)①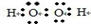 ②+482 kJ·mol-1③120.5 kJ.;⑵①其他条件不变,在碱性环境下加快H2O2的分解速率,酸性环境下减缓H2O2的分解速率;②随着反应的进行H2O2的浓度逐渐减少,H2O2的分解速率逐渐减慢。
②+482 kJ·mol-1③120.5 kJ.;⑵①其他条件不变,在碱性环境下加快H2O2的分解速率,酸性环境下减缓H2O2的分解速率;②随着反应的进行H2O2的浓度逐渐减少,H2O2的分解速率逐渐减慢。
解析试题分析:(1)①双氧水是一种含有氧氧共价键和氧氢共价键的极性分子,电子式为: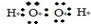
② 断裂化学键吸收能量、形成化学键放出能量,根据水分解化学方程:2H2O(g)=2H2(g)+2O2(g)可知:2molH2O含有4mol O—H,则断裂需要吸收的能量为463 kJ·mol-1×4mol=1852KJ,形成2 mol H—H和1 mol O=O释放的能量之和为:(436 kJ·mol-1×2mol)+498 kJ·mol-1×1mol=1370KJ;1852KJ>1370KJ,当断裂化学键吸收的能量大于形成化学键吸收的能量时,反应吸热,该反应吸收的热量为:1852KJ-1370KJ=+482 kJ,所以该反应的热化学方程式为:2H2O(g)=2H2(g)+2O2(g) △H=+482 kJ·mol-1
③根据热化学方程式计算式可以进行逆运算的原理,将②中2H2O(g)=2H2(g)+2O2(g) △H=+482 kJ·mol-1
热化学方程式颠倒后得到:2H2(g)+2O2(g) =2H2O(g)△H=-482 kJ·mol-1,然后将11.2LH2转化为0.5mol,再依据刚得到的H2燃烧的热化学方程式进行计算得出11.2L H2完全燃烧时放出的热量为: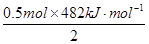 =120.5 kJ.
=120.5 kJ.
⑵①结合函数图像可知,曲线C最先出现拐点,所用的时间少,而曲线b出现拐点较晚,所用的时间长,由此可知,在其他条件不变时,在碱性环境下加快H2O2的分解速率,酸性环境下减缓H2O2的分解速率。
②随着反应的进行H2O2的浓度逐渐减少,H2O2的分解速率逐渐减慢。
考点:考查电子式、从化学键发生变化的角度书写热化学方程、应用盖斯定律考查反应热的计算、化学反应速率及其影响因素。

(1) 8g液态的CH3OH在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出Q kJ的热量。试写出液态CH3OH燃烧热的热化学方程式 。
(2)在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
| 化学键 | H—H | N—H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
试根据表中所列键能数据计算a的数值为: 。
(3)已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol
根据盖斯定律,由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式:
。
 SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。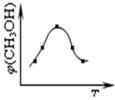
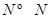 键分别需要的能量是436kJ、391KJ、946kJ,则N2与H2反应生成1mol NH3(g)的热化学方程式是___________________.
键分别需要的能量是436kJ、391KJ、946kJ,则N2与H2反应生成1mol NH3(g)的热化学方程式是___________________. 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0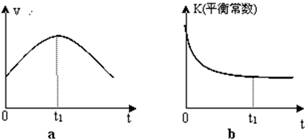
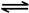 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol  CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0