题目内容
研究NO2、SO2 、CO等大气污染气体的测量及处理具有重要意义。
(1)I2O5可使H2S、CO、HC1等氧化,常用于定量测定CO的含量。已知:
2I2(s)+5O2(g)=2I2O5(s) △H=-75.56 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式: 。
(2)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g) SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
SO3(g)+NO(g)将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1molSO2的同时生成1molNO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K= 。
(3)从脱硝、脱硫后的烟气中获取二氧化碳,用二氧化碳合成甲醇是碳减排的新方向。将CO2转化为甲醇的热化学方程式为:CO2 (g)+3H2(g) CH3OH(g)+H2O(g) △H3
CH3OH(g)+H2O(g) △H3
①取五份等体体积CO2和H2的的混合气体 (物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH) 与反应温度T的关系曲线如图所示,则上述CO2转化为甲醇反应的△H3 0(填“>”、“<”或“=”)。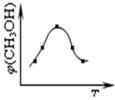
②在容积为1L的恒温密闭容器中充入1molCO2和3molH2,进行上述反应。测得CO2和CH3OH(g)的浓度随时间变化如下左图所示。若在上述平衡体系中再充0.5molCO2和1.5mol水蒸气(保持温度不变),则此平衡将 移动(填“向正反应方向”、“不”或“逆反应方向”)。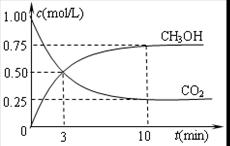
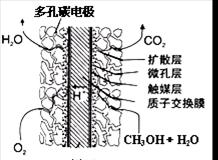
③直接甲醇燃料电池结构如上右图所示。其工作时负极电极反应式可表示为 。
(1)5CO(g)+I2O5(s)=5CO2(g)+I2(s) △H=-1377.22kJ/mol
(2)b 2.67或8/3 (3)①< ②不 ③CH3OH-6e-+H2O=6H++CO2
解析试题分析:(1)根据反应①2I2(s)+5O2(g)=2I2O5(s) △H=-75.56 kJ·mol-1、②2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1并依据盖斯定律可知,(②×5-①)÷2即得到反应5CO(g)+I2O5(s)=5CO2(g)+I2(s),所以该反应的反应热△H=(-566.0 kJ/mol×5+75.56 kJ/mol)÷2=-1377.22kJ/mol。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。该反应是反应前后气体分子数不变的反应,故体系的压强保持不变,故a不能说明反应已达到平衡状态;颜色深浅和浓度有关系,随着反应的进行,NO2的浓度减小,颜色变浅,故b可以说明反应已达平衡;SO3和NO都是生成物,比例保持1:1,故c不能作为平衡状态的判断依据;根据方程式可知,每消耗1molSO2的同时一定生成1molNO ,即d中所述的两个速率方向相同,不能作为平衡状态的判断依据,所以正确的答案选b。反应前后体积不变,因此可以用物质的量表示浓度计算平衡常数,则
NO2(g)+SO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
起始量(mol) n 2n 0 0
转化量(mol) x x x x
平衡量(mol) n-x 2n-x x x
则根据平衡时NO2与SO2体积比为1∶6可知6×(n-x)=2n-x
解得x=0.8n
所以该反应的平衡常数K=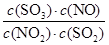 =
= =
=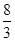
(3)①由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡向吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H3<0。
②根据图像可知,平衡时甲醇的浓度是0.75mol/L,则根据反应方程式CO2 (g)+3H2(g) CH3OH(g)+H2O(g)可知,消耗CO2和氢气的浓度分别是0.75mol/L和2.25mol/L,生成水蒸气的浓度是0.75mol/L。则平衡时CO2和氢气的浓度分别是1mol/L-0.75mol/L=0.25mol/L、3mol/L-2.25mol/L=0.75mol,所以该反应的平衡常数K=
CH3OH(g)+H2O(g)可知,消耗CO2和氢气的浓度分别是0.75mol/L和2.25mol/L,生成水蒸气的浓度是0.75mol/L。则平衡时CO2和氢气的浓度分别是1mol/L-0.75mol/L=0.25mol/L、3mol/L-2.25mol/L=0.75mol,所以该反应的平衡常数K=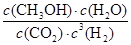 =
=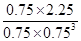 =
=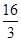 。若在上述平衡体系中再充0.5molCO2和1.5mol水蒸气(保持温度不变),则此时浓度商为
。若在上述平衡体系中再充0.5molCO2和1.5mol水蒸气(保持温度不变),则此时浓度商为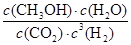 =
=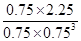 =
=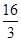 ,所以此平衡将不移动。
,所以此平衡将不移动。
③原电池中正极得到电子,发生还原反应,因此氧气在正极通入,氧气得电子和氢离子反应生成水,电极反应式为O2+4e-+4H+=2H2O。负极失去电子,发生氧化反应,因此甲醇在负极通入,电极反应式为CH3OH-6e-+H2O=6H++CO2。
考点:考查反应热的计算、平衡状态的判断、平衡常数计算和应用、外界条件对平衡状态的影响以及电极反应式的书写等

 阅读快车系列答案
阅读快车系列答案氢氧两种元素形成的常见物质有H2O与H2O2,在一定条件下均可分解。
(1)已知:
| 化学键 | 断开1mol化学键所需的能量(kJ) |
| H—H | 436 |
| O—H | 463 |
| O=O | 498 |
②H2O(g)分解的热化学方程式是 。
③11.2 L(标准状况)的H2完全燃烧,生成气态水,放出 kJ的热量。
(2)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响。常温下,按照如表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 | |
| a | 50 mL 5% H2O2溶液 | | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| b | 50 mL 5% H2O2溶液 | 少量浓盐酸 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| c | 50 mL 5% H2O2溶液 | 少量浓NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| d | 50 mL 5% H2O2溶液 | | MnO2 |
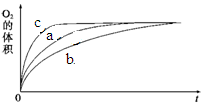
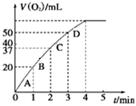
图1 图2
由该图能够得出的实验结论是_________。
②测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示。解释反应速率变化的原因: 。
金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝。高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s) + 3H2 (g) W (s) + 3H2O (g)
W (s) + 3H2O (g)
请回答下列问题:
⑴上述反应的化学平衡常数表达式为___________________________。
⑵某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为_____________________;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应_____________________(填“吸热”或“放热”)。
⑶上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃ ~ 550℃ ~ 600℃ ~ 700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
第一阶段反应的化学方程式为___________________________;580℃时,固体物质的主要成分为________;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为____________________________________。
⑷ 已知:温度过高时,WO2 (s)转变为WO2 (g);
WO2 (s) + 2H2 (g)
 W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1
W (s) + 2H2O (g);ΔH = +66.0 kJ·mol-1 WO2 (g) + 2H2(g)
 W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1
W (s) + 2H2O (g);ΔH = -137.9 kJ·mol-1 则WO2 (s)
 WO2 (g) 的ΔH = ______________________。
WO2 (g) 的ΔH = ______________________。⑸钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s) +2I2 (g)
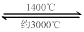 WI4 (g)。下列说法正确的有____________。
WI4 (g)。下列说法正确的有____________。a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢
尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2(l) △H=-103.7 kJ·mol-1
下列措施中有利于提高尿素的生成速率的是
| A.采用高温 |
| B.采用高压 |
| C.寻找更高效的催化剂 |
| D.减小体系内CO2浓度 |
第一步:2NH3(l)+CO2(g)
 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1第二步:H2NCOONH4(l)
 H2O(l)+H2NCONH2(l) △H2.
H2O(l)+H2NCONH2(l) △H2.某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和l mol二氧化碳,实验测得反应中各组分随时间的变化如下图I所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定,总反应进行到 min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上图II所示,则△H2 0(填“>” “<” 或 “=”)
(3)在温度70-95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2
①尿素与NO、NO2三者等物质的量反应,化学方程式为
②已知:N2(g)+O2(g)=2NO(g).△H=180.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol-1
则4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g) △H= kJ·mol-1
(4)尿素燃料电池结构如上图III所示。其工作时负极电极反应式
可表示为 。
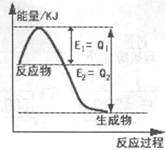
 CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。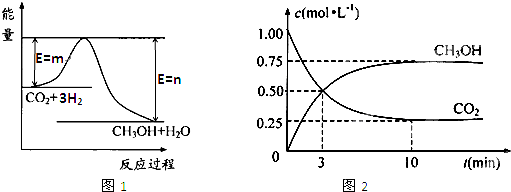
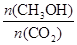 增大的有 。
增大的有 。 、
、 的代数式表示)。
的代数式表示)。
 O2(g)═H2O(g);△H=-241.5kJ/mol,该反应的活化能为167. 4kJ/mol,则其逆反应的活化能为________________。
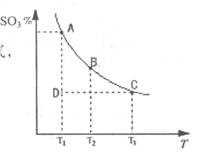
O2(g)═H2O(g);△H=-241.5kJ/mol,该反应的活化能为167. 4kJ/mol,则其逆反应的活化能为________________。 2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):
2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):