题目内容
(1) 8g液态的CH3OH在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出Q kJ的热量。试写出液态CH3OH燃烧热的热化学方程式 。
(2)在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
| 化学键 | H—H | N—H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
试根据表中所列键能数据计算a的数值为: 。
(3)已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol
根据盖斯定律,由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式:
。
.(1)CH3OH(l)+3/2 O2(g)="=" CO2(g)+2H2O(l) ΔH=-4QKJ/mol
(2) -93。 (3)2C(s,石墨)+H2(g)=C2H2(g)  KJ/mol
KJ/mol
解析试题解析:(1) 燃烧热是1 mol可燃物完全燃烧生成稳定氧化物释放的热量。8g CH3OH燃烧放热Q kJ,则1 molCH3OH完全燃烧放热4Q kJ.所以CH3OH(l)+ O2(g)="=" CO2(g)+2H2O(l) ΔH=-4QKJ/mol;
(2) ΔH=反应物的键能总和-生成物的键能总和=(945+3×436)kJ/mol -2×3×391 kJ/mol ="-93" kJ/mol,即a=-93
(3) :C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol ①
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol ②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol ③
由 (①×4+ ②-③)/2得
2C(s,石墨)+H2(g)=C2H2(g)  KJ/mol
KJ/mol
考点:盖斯定律的应用和热化学方程式的书写

练习册系列答案
相关题目
氢氧两种元素形成的常见物质有H2O与H2O2,在一定条件下均可分解。
(1)已知:
| 化学键 | 断开1mol化学键所需的能量(kJ) |
| H—H | 436 |
| O—H | 463 |
| O=O | 498 |
②H2O(g)分解的热化学方程式是 。
③11.2 L(标准状况)的H2完全燃烧,生成气态水,放出 kJ的热量。
(2)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响。常温下,按照如表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 | |
| a | 50 mL 5% H2O2溶液 | | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| b | 50 mL 5% H2O2溶液 | 少量浓盐酸 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| c | 50 mL 5% H2O2溶液 | 少量浓NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| d | 50 mL 5% H2O2溶液 | | MnO2 |
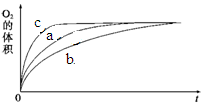
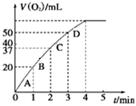
图1 图2
由该图能够得出的实验结论是_________。
②测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示。解释反应速率变化的原因: 。
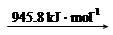 2N (g)
2N (g)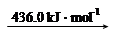 2H (g)
2H (g)
 (3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为: 可制取甲醇,其反应为:CO2+3H2
可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:

 溶液喷淋“捕捉”空气中的
溶液喷淋“捕捉”空气中的 。
。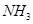 为原料可合成化肥尿素[
为原料可合成化肥尿素[ ]。已知:
]。已知:
 ①
①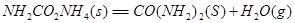
 ②
②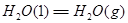
 ③
③ ,在催化剂作用下CO和
,在催化剂作用下CO和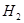 反应生成甲醇:
反应生成甲醇: 某容积可变的密闭容器中充有10molCO与20mol
某容积可变的密闭容器中充有10molCO与20mol
 _______VL。(填“大于”、“小于”或“等于”)
_______VL。(填“大于”、“小于”或“等于”)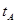 _______
_______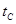 (填“>”、“<”或“=”)
(填“>”、“<”或“=”) 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
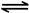 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol