题目内容
臭氧可用于净化空气、饮用水消毒、处理工业废物和作为漂白剂。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)= 3Ag2O(s); △H=-236kJ·mol-1,
已知:2Ag2O(s)= 4Ag(s)+O2(g); △H=" +62" kJ·mol-1,
则O3转化为O2的热化学方程式为________________________________________________。
(2)臭氧在水中易分解,臭氧的浓度减少一半所需的时间如下表所示。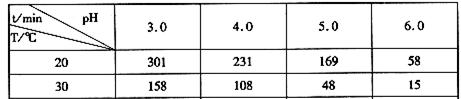
由上表可知pH增大能加速O3分解,表明对O3分解起催化作用的是__________(填微粒符号)。
(3)电解法臭氧发生器具有臭氧浓度高、成分纯净、在水中溶解度高的优势,在医疗、食品加工与养殖业及家庭方面具有广泛应用前景。科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。
臭氧在阳极周围的水中产生,其电极反应式为_______________________;阴极附近的氧气则生成过氧化氢,其电极反应式为_______________________。
(1)2O3=3O2 △H="-286kJ/mol" (3分)(2)OH- (1分)
(3)3H2O-6e-=O3↑+6H+ (3分) 3O2+6H++6e-=3H2O2(3分)
解析试题分析:(1)①6Ag(s)+O3(g)=3Ag2O(s)△H=-235.8kJ?mol-1,②2Ag2O(s)=4Ag(s)+O2(g)△H=+62.2kJ?mol-1,根据盖斯定律可知①×2+②×3可得到,2O3(g)=3O2(g),则反应热△H=(-235.8kJ?mol-1)×2+(+62.2kJ?mol-1)×3=-285kJ/mol,所以热化学方程式为2O3(g)=3O2(g)△H=-285kJ/mol(2)由表格中的数据可知,相同温度下,pH越大,O3分解速率越大,表明对O3分解起催化作用的是OH-(3) 酸性条件下电解水的方法制得臭氧.臭氧在阳极周围的水中产生,其电极反应式为3H2O-6e-=O3↑+6H+,阴极附近的氧气则生成过氧化氢,其电极反应式为3O2+6H++6e-=3H2O2
考点:热化学方程式;化学反应速率的影响因素;电解原理

汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g)+O2(g)  2NO(g) ΔH,已知该反应在 T ℃时,平衡常数K=9.0。
2NO(g) ΔH,已知该反应在 T ℃时,平衡常数K=9.0。
请回答:
(1)已知:N2(g)+2O2(g)  2NO2(g) ΔH1 2NO2(g)
2NO2(g) ΔH1 2NO2(g)  O2+2NO(g) ΔH2 ΔH= (用含ΔH1、ΔH2的表达式表示);
O2+2NO(g) ΔH2 ΔH= (用含ΔH1、ΔH2的表达式表示);
(2)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则NO的反应速率 ;
(3)假定该反应是在恒容条件下进行,下列能判断该反应已达到平衡的是________;
| A.消耗1 mol N2同时生成1 mol O2 |
| B.混合气体密度不变 |
| C.混合气体平均相对分子质量不变 |
| D.2v正(N2)=v逆(NO) |
 2NO(g)的“K-T”、“c(NO)-t”图,由图A可以推知该反应为 反应(填“吸热”或“放热”)。由图B可知,与a对应的条件相比,b改变的条件可以是 ;
2NO(g)的“K-T”、“c(NO)-t”图,由图A可以推知该反应为 反应(填“吸热”或“放热”)。由图B可知,与a对应的条件相比,b改变的条件可以是 ;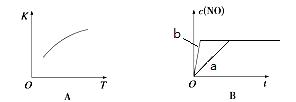
(5)T ℃时,某时刻测得容器内N2、O2、NO的浓度分别为0.20 mol·L-1、0.20mol·L-1和0.50mol·L-1,此时反应N2(g)+O2(g)
 2NO(g)________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),平衡时,N2在混合气体的体积百分数为多少?(在答题卡上写出具体计算过程,结果保留2位有效数字)
2NO(g)________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),平衡时,N2在混合气体的体积百分数为多少?(在答题卡上写出具体计算过程,结果保留2位有效数字) 氢氧两种元素形成的常见物质有H2O与H2O2,在一定条件下均可分解。
(1)已知:
| 化学键 | 断开1mol化学键所需的能量(kJ) |
| H—H | 436 |
| O—H | 463 |
| O=O | 498 |
②H2O(g)分解的热化学方程式是 。
③11.2 L(标准状况)的H2完全燃烧,生成气态水,放出 kJ的热量。
(2)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响。常温下,按照如表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 | |
| a | 50 mL 5% H2O2溶液 | | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| b | 50 mL 5% H2O2溶液 | 少量浓盐酸 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| c | 50 mL 5% H2O2溶液 | 少量浓NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| d | 50 mL 5% H2O2溶液 | | MnO2 |
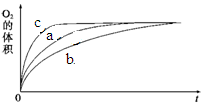
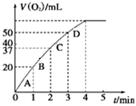
图1 图2
由该图能够得出的实验结论是_________。
②测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示。解释反应速率变化的原因: 。
 CH3OH(g),ΔH=-90.1 kJ·mol-1 在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。
CH3OH(g),ΔH=-90.1 kJ·mol-1 在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。

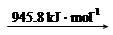 2N (g)
2N (g)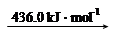 2H (g)
2H (g)
 (3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为: CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。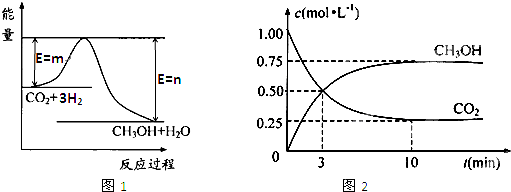
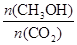 增大的有 。
增大的有 。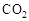 可制取甲醇,其反应为:CO2+3H2
可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:
CH3OH+H2O 常温常压下已知下列反应的能量变化如图示:

 溶液喷淋“捕捉”空气中的
溶液喷淋“捕捉”空气中的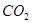 。
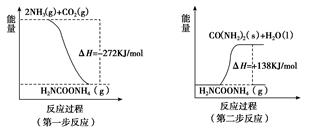
。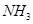 为原料可合成化肥尿素[
为原料可合成化肥尿素[ ]。已知:
]。已知:
 ①
①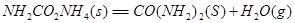
 ②
②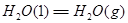
 ③
③ ,在催化剂作用下CO和
,在催化剂作用下CO和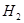 反应生成甲醇:
反应生成甲醇: 某容积可变的密闭容器中充有10molCO与20mol
某容积可变的密闭容器中充有10molCO与20mol
 _______VL。(填“大于”、“小于”或“等于”)
_______VL。(填“大于”、“小于”或“等于”)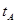 _______
_______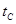 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)