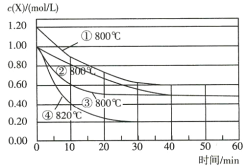
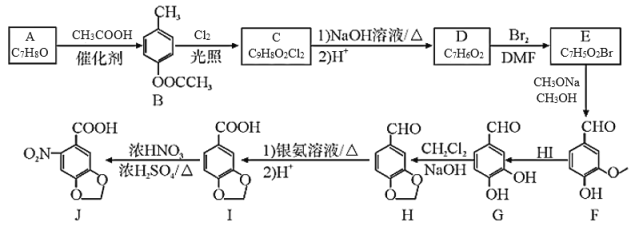
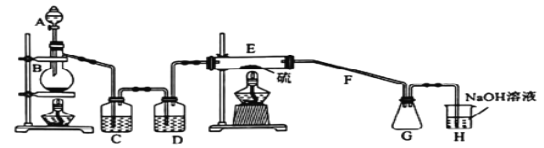
题目内容
【题目】常温下,在pH=5的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
A.加入水时,平衡向右移动,CH3COOH电离常数增大
B.加入少量CH3COONa固体,平衡向右移动
C.加入少量NaOH固体,平衡向右移动,c(H+)减小
D.加入少量pH=5的硫酸,溶液中c(H+)增大
【答案】C
【解析】
试题A. 加入水时,醋酸的电离平衡向右移动,但是CH3COOH电离常数不会发生变化,错误;B. 加入少量CH3COONa固体,由于c(CH3COO-)增大,电离平衡向左移动,错误;C. 加入少量NaOH固体,由于c(OH-)增大,消耗酸电离产生的H+,使醋酸的电离平衡向右移动,但是由于平衡移动的趋势是微弱的,总的来说c(H+)减小,正确;D. 加入少量pH=5的硫酸,由于二者的pH相同,所以溶液中c(H+)不变,错误。

练习册系列答案
相关题目