题目内容
【题目】常温下,向![]() 溶液中逐滴加入
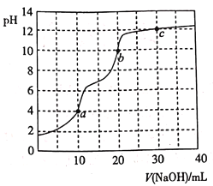
溶液中逐滴加入![]() 溶液,混合溶液的pH随KOH溶液的加入变化情况如图,下列结论错误的是( )
溶液,混合溶液的pH随KOH溶液的加入变化情况如图,下列结论错误的是( )

A.当加入![]() mLKOH溶液时,所得溶液中水的电离程度大于X点溶液的水的电离程度
mLKOH溶液时,所得溶液中水的电离程度大于X点溶液的水的电离程度
B.HA为弱酸,常温下,Ka的数量级为![]()
C.Y点对应的溶液中:![]()
D.若用KOH溶液滴定HA溶液,可选用甲基橙作指示剂
【答案】D
【解析】
A.当加入![]() mL KOH溶液时HA与KOH恰好反应生成KA,酸和碱都无剩余,此时水的电离程度最大,即所得溶液中水的电离程度大于X点溶液的水的电离程度,故A正确;
mL KOH溶液时HA与KOH恰好反应生成KA,酸和碱都无剩余,此时水的电离程度最大,即所得溶液中水的电离程度大于X点溶液的水的电离程度,故A正确;
B.![]() 溶液的
溶液的![]() ,说明HA为弱酸,此时
,说明HA为弱酸,此时![]() ,
,![]() ,则HA的电离平衡常数
,则HA的电离平衡常数![]() ,故B正确;
,故B正确;
C.Y点对应的溶液中溶质为等浓度的KA和KOH,![]() 部分水解,则
部分水解,则![]() ,溶液中离子浓度大小为:
,溶液中离子浓度大小为:![]() ,故C正确;
,故C正确;
D.滴定终点时溶液呈碱性,应该选用酚酞作指示剂,不能用甲基橙,故D错误;
选D。

练习册系列答案
相关题目