题目内容
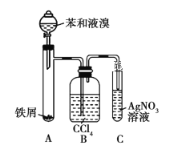
【题目】实验室进行二氧化硫制备与性质实验的组合装置如图所示,部分夹持装置未画出。

请回答下列问题:
(1)在组装好装置后,首先要进行的实验操作为_________________________________。
(2)为检验SO2与Na2O2的反应是否有氧气生成,装置B中盛放的试剂X应为________,装置D中碱石灰的作用是_______________________________________________。
(3)关闭弹簧夹2,打开弹簧夹1,注入70%的硫酸至浸没三颈烧瓶中的固体,检验SO2与Na2O2反应是否有氧气生成的操作及现象是_____________________________________。
(4)关闭弹簧夹1,打开弹簧夹2,残余气体进入装置E、F、G中,能说明I-的还原性弱于SO2的现象为_________________。发生反应的离子方程式是______________________。
(5)为了验证装置E中SO2与FeCl3发生了氧化还原反应,某学生设计了如下实验:取少量装置E中的溶液于试管中,向其中加入稀硝酸酸化的BaCl2溶液,产生白色沉淀,并由此判断SO2与FeCl3发生了氧化还原反应。上述方案是否合理?________(填“合理”或“不合理”),原因是________。
【答案】 检查装置的气密性 浓硫酸 吸收未反应的SO2,防止污染空气,同时防止空气中的水蒸气进入装置与Na2O2反应,干扰实验 将带火星的木条放在干燥管D出口处,若木条复燃,则有氧气生成,否则无氧气生成 装置F中溶液蓝色褪去 SO2+I2+2H2O===2I-+SO![]() +4H+ 不合理 装置E中溶液溶解的SO2可被稀硝酸氧化成SO
+4H+ 不合理 装置E中溶液溶解的SO2可被稀硝酸氧化成SO![]() ,也可与BaCl2反应,生成白色沉淀,会对SO2与FeCl3反应产物(SO
,也可与BaCl2反应,生成白色沉淀,会对SO2与FeCl3反应产物(SO![]() )的检验造成干扰
)的检验造成干扰
【解析】由题意结合流程,A为SO2的制取装置;B为吸水装置,防止水蒸气与Na2O2反应,干扰SO2与Na2O2反应的实验探究;C为SO2与Na2O2反应装置;D为隔绝空气及尾气吸收装置;E、F为探究SO2还原性的装置;G为尾气吸收装置。
(1)有气体参与或生成的实验装置组装好后的第一步操作都是检查装置的气密性。
(2)因为Na2O2能与水蒸气反应产生氧气,所以要检验SO2与Na2O2反应是否有氧气生成,为避免干扰,应先除去水蒸气;SO2是有毒的酸性氧化物,可用碱石灰吸收,以防止污染,同时碱石灰可防止空气中的水蒸气、CO2进入装置与Na2O2反应,干扰实验。
(3)检验氧气用带火星的木条,木条复燃则证明有氧气生成。
(4)关闭弹簧夹1,打开弹簧夹2,SO2气体进入装置E、F、G中,若装置F中溶液蓝色褪去,则说明I-的还原性弱于SO2;发生反应的离子方程式是SO2+I2+2H2O=2I-+SO42-+4H+。
(5)评价该实验方案时,要考虑检验试剂与原溶液中所含物质的反应是否会对实验造成干扰。装置E中溶液溶解的SO2可被稀硝酸氧化成SO42-,也可与BaCl2反应,生成白色沉淀,会对SO2与FeCl3反应产物(SO42-)的检验造成干扰,所以该同学的方案不合理。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表:
2Z(g),各组分在不同时刻的浓度如下表:
物质 | X | Y | Z |
初始浓度/(mol·L-1) | 0.1 | 0.2 | 0 |
2 min末浓度/(mol·L-1) | 0.08 | a | b |
平衡浓度/(mol·L-1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是( )
A. 平衡时,X的转化率为20%
B. 2 min时Y的物质的量为0.14
C. 增大平衡后的体系压强,v(正)增大,v(逆)减小
D. 2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol·L―1·min―1