题目内容
【题目】C1O2是常用的自来水消毒剂。
I.已知实验室可用亚氯酸钠固体与氯气反应制备ClO2:2NaClO2+C12 =2C1O2+2NaCl,装置如下图所示:
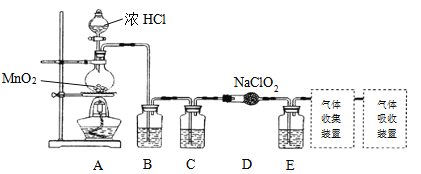
(1)圆底烧瓶内发生反应的化学方程式是:__________。
(2)已知常温常压下,ClO2和Cl2是气体,在下列溶剂中溶解性如下表所示:
ClO2 | Cl2 | |
水 | 极易溶于水 | 溶 |
CCl4 | 难溶 | 溶 |
B、C、E装置中的试剂依次是_________(填序号)。
a.NaOH溶液 b.浓硫酸 c.饱和食盐水 d.CCl4 e.饱和石灰水
II.使用C1O2在给自来水消毒的过程中会产生有害的副产物亚氯酸根(ClO2-),可用Fe2+将其去除。已知ClO2-与Fe2+在pH=5~7的条件下能快速反应,最终形成红褐色沉淀,而ClO2-则被还原成Cl-。
(3)Fe2+消除ClO2-的离子方程式为_______。
(4)实际向自来水中加入Fe2+的量要高于理论值,原因是(结合离子方程式解释)___________。
【答案】MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O cbd ClO2-+4Fe2++10H2O=4Fe(OH)3↓+Cl-+8H+ Fe2+易被水中溶解的氧气氧化,4Fe2++O2+10H2O=4Fe(OH)3↓+8H+
MnCl2+Cl2↑+2H2O cbd ClO2-+4Fe2++10H2O=4Fe(OH)3↓+Cl-+8H+ Fe2+易被水中溶解的氧气氧化,4Fe2++O2+10H2O=4Fe(OH)3↓+8H+
【解析】
由题目中所给信息和实验装置图可知:实验首先用浓盐酸和MnO2在加热条件下反应制备Cl2,反应的方程式为MnO2+4HCl(浓) ![]() MnCl2++Cl2↑+2H2O,经除杂、干燥后在D中亚氯酸钠固体反应生成ClO2,B装置除去氯气中的氯化氢,C装置用浓硫酸进行干燥,由于Cl2易溶于CCl4液体,E用于除去ClO2中的未反应的Cl2,最后用向上排空法、或排水法收集,并注意气体的性质和装置来分析防止倒吸的装置。
MnCl2++Cl2↑+2H2O,经除杂、干燥后在D中亚氯酸钠固体反应生成ClO2,B装置除去氯气中的氯化氢,C装置用浓硫酸进行干燥,由于Cl2易溶于CCl4液体,E用于除去ClO2中的未反应的Cl2,最后用向上排空法、或排水法收集,并注意气体的性质和装置来分析防止倒吸的装置。
(1)圆底烧瓶中浓盐酸和MnO2在加热条件下反应制备Cl2,两者反应生成二氯化锰、氯气、水;
(2)氯化氢易挥发,浓盐酸和MnO2在加热条件下反应制备Cl2,氯气中混有氯化氢,可用饱和食盐水除去气体中混有的HCl杂质,因氯气从溶液中制取,所以氯气中混有水蒸气,浓硫酸干燥除去水,E用于除去ClO2中的未反应的Cl2;
(3)ClO2-与Fe2+在pH=5~7的条件下能快速反应,最终形成红褐色沉淀,该沉淀为Fe(OH)3,而ClO2-则被还原成Cl-,据此结合化合价升降相等配平该反应的离子方程式;
(4)Fe2+具有较强换一下,易被水中溶解的氧气氧化,故实际向自来水中加入Fe2+的量要高于理论值。
(1)实验室用浓盐酸和MnO2在加热条件下反应制备Cl2,浓盐酸盛装在分液漏斗中,烧瓶内为MnO2,浓盐酸和MnO2在加热条件下反应生成二氯化锰、氯气、水,反应方程式为:MnO2+4HCl(浓) ![]() MnCl2++Cl2↑+2H2O;
MnCl2++Cl2↑+2H2O;
(2)由于浓盐酸具有挥发性,所以在加热时制取的氯气中混有杂质HCl和水蒸气,为制备纯净干燥的氯气,根据氯气不溶于饱和食盐水的性质,可用饱和食盐水除去气体中混有的HCl杂质,然后用浓硫酸干燥除去水蒸气,由于Cl2易溶于CCl4液体,E用于除去ClO2中的未反应的Cl2,所以B、C、E装置中的试剂依次为:饱和食盐水、浓硫酸、CCl4,故B、C、E装置中的试剂序号依次是cbd;
(3)ClO2-与Fe2+在pH=5~7的条件下能快速反应,最终形成红褐色沉淀,该沉淀为Fe(OH)3,铁元素化合价升高了1,而ClO2-则被还原成Cl-,化合价降低了4价,根据氧化还原反应中化合价升降总数相等,可知Fe2+和Fe(OH)3的系数为4,ClO2-、Cl-的系数为1,结合质量守恒,配平该反应的离子方程式为:ClO2-+4Fe2++10H2O=4Fe(OH)3↓+Cl-+8H+;
(4)由于Fe2+易被水中溶解的氧气氧化,发生反应为4Fe2++O2+10H2O=4Fe(OH)3↓+8H+,所以实际向自来水中加入Fe2+的量要高于理论值。

【题目】向2 L的恒容密闭容器中通入气体X和Y,发生反应X(g)+Y(g)![]() Z(g) ΔH,所得实验数据如下表:
Z(g) ΔH,所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | 达到平衡的时间/min | |
n(X) | n(Y) | n(Z) | |||
① | 400 | 4.0 | 3.0 | 2.0 | 2 |
② | 500 | 4.0 | 3.0 | 1.0 | 1 |
③ | 500 | 4.0 | 1.0 | ||
下列说法不正确的是
A. 该反应正反应为放热反应
B. ①中,0-2min内,用Y表示的平均反应速率υ (Y)=1 mol/(L·min)
C. ③中,达到平衡时,该反应的平衡常数K=![]()
D. ③中,达到平衡时,n(Z)<1.0 mol
【题目】2015年9月20日是第27个“全国爱牙日”。为了防止龋齿,正确的刷牙方式和选用适宜的牙膏很重要。对牙膏中的物质的探究要用到许多化学知识。
下表列出了三种牙膏中的摩擦剂:
牙膏 | ×××牙膏 | ×××牙膏 | ××牙膏 |
摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
(1)三种牙膏的摩擦剂中,氢氧化铝是氢氧化物,碳酸钙和二氧化硅分别是____、____(填物质类别)。
(2)根据你的推测,牙膏摩擦剂的溶解性___(填“易溶”和“难溶”)。
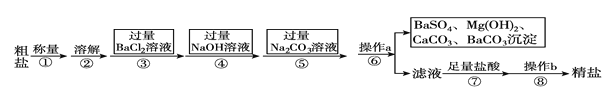
(3)牙膏中的摩擦剂碳酸钙可以用石灰石来制备。某同学设计了一种实验室制备碳酸钙的实验方案,其流程图为:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请写出上述方案中反应③的化学方程式:____。
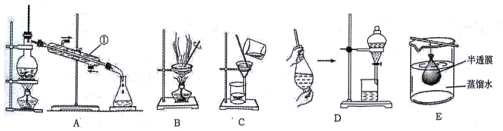
【题目】化学课上,同学们利用下列实验探究碱的化学性质:
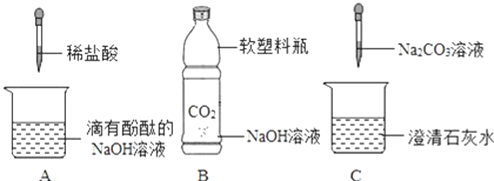
(1)A实验中观察到的现象是_______。
(2)B实验中发生的离子反应方程式是_____。
(3)C实验中发生的离子反应方程式是____。
(4)实验结束后,同学们将废液倒入同一只废液缸中,最后发现废液浑浊并显红色。
(提出问题)废液中含有什么物质?
(假设猜想)通过分析,同学们猜想:废液中除酚酞、碳酸钙及水以外一定含有_____。
老师问:废液中还可能有什么物质?引发了同学们热烈讨论,下面是大家的发言:
学生甲 | 可能有CaCl2、Na2CO3 | 学生丙 | 可能有Ca(OH)2、CaCl2 |
学生乙 | 可能有NaOH、Na2CO3 | 学生丁 | 可能有Na2CO3 |
学生戊 | 可能有NaOH | … | … |
上述几位学生的猜想中,有一种明显不合理,你认为谁的猜想不合理?并说明理由。_____
(实验验证)同学们对可能含有的物质进行确定,取一定量的废液过滤,向滤液中逐滴加入氯化钡溶液,得到白色沉淀,红色褪去。
(结论)上述废液中,还含有____,没有_____。