题目内容
15.下列关于反应速率的说法正确的是( )| A. | v=0.10 mol•L-1•s-1是指1 s内某物质的物质的量浓度为0.10 mol•L-1 | |
| B. | 对于任何化学反应来说,反应速率越快,反应现象就越明显 | |
| C. | 化学反应速率只是对可逆反应才适用 | |
| D. | 根据反应速率的大小,可以知道反应进行的相对快慢 |
分析 A、化学反应速率是指单位时间内物质浓度的变化;
B、反应速率越快,反应现象不一定明显,如电解质在溶液中的反应,有的瞬间完成;
C、化学反应速率适用于任何溶液浓度变化的反应;
D、化学反应速率是衡量化学反应快慢的物理量.
解答 解:A、v=0.10 mol•L-1•s-1是指1 s内某物质的物质的量浓度的变化为0.10 mol•L-1,故A错误;
B、反应速率越快,反应现象不一定明显,如酸碱中和反应,故B错误;
C、化学反应速率适用于任何溶液浓度变化的反应,不一定是可逆反应,故C错误;
D、化学反应速率大小是衡量化学反应相对快慢的物理量,故D正确;
故选D.
点评 本题考查了化学反应速率的概念分析,表示方法和实质理解应用,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
6.将SO2气体通入BaCl2溶液至饱和,未见有沉淀生成,继续通入另一种气体却有沉淀产生.则通入的气体可能是( )
①CO2 ②NH3 ③N2 ④Cl2⑤O3⑥H2 ⑦NO2.
①CO2 ②NH3 ③N2 ④Cl2⑤O3⑥H2 ⑦NO2.
| A. | ①②③④⑤ | B. | 全部 | C. | ②④⑤⑦ | D. | ①④⑤⑦ |
3.实现下列变化时,需克服相同类型作用力的是( )
| A. | 水晶和干冰的熔化 | B. | 食盐和冰醋酸熔化 | ||
| C. | 液溴和液汞的气化 | D. | 纯碱和烧碱的熔化 |
20.下列对一些实验事实的理论解释正确的是( )
| 选项 | 实 验 事 实 | 理 论 解 释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子半径小于氧原子 |
| B | 干冰的熔沸点低 | 干冰为分子晶体 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
| A. | A | B. | B | C. | C | D. | D |
7.沼气是一种能源,它的主要成分是CH4.已知25℃时,8g CH4完全燃烧生成CO2和H2O时,放出445kJ热量,则下列热化学方程式正确的是( )
| A. | 2 CH4 (g)+4O2(g)=2CO2(g)+4H2O(l)△H=+890kJ/mol | |
| B. | CH4+2 O2=CO2+2H2O△H=-890kJ/mol | |
| C. | CH4 (g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol | |
| D. | $\frac{1}{2}$CH4 (g)+O2(g)=$\frac{1}{2}$CO2(g)+H2O(g)△H=-445kJ/mol |
4.在密闭容器中进行X2(气)+2Y2(气)?Z(气)的反应,X2、Y2、Z的起始浓度依次为0.2mol/L、0.3mol/L、0.3mol/L,当反应达到其最大限度(即化学平衡状态)时,各物质的浓度有可能的是( )
| A. | c(Z)=0.45mol/L | B. | c(Y2)=0.5mol/L | C. | c(X2)=0 | D. | c(X2)=0.5mol/L |
 .
. NH3•H2ONH3•H2O
NH3•H2ONH3•H2O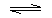 NH4++OH-
NH4++OH-