题目内容
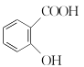
【题目】草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。H2CO3 K1=4.5×10-7 K2= 4.7×10-11 , 草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
(1)写出水溶液中草酸的电离方程式:_____________________________________________;
(2)生活中,常用热纯碱溶液清洗油污,纯碱溶液遇酚酞显红色,请用离子方程式解释显红色的原因:________________________________________________________________;
(3)相同条件下等物质的量浓度的Na2C2O4溶液的pH比Na2CO3溶液的pH_____ (填“大”、“小”或“相等”);
(4)向1L 0.02mol/L H2C2O4溶液中滴加1L 0.01mol/L NaOH溶液。混合溶液中c(H+)>c(OH-),下列说法中正确的是(______)
A.c(H2C2O4)>c(HC2O4-) B.c(Na+)+c(H+)=2c(C2O42-)+ c(HC2O4-)+c(OH-)
C.c(OH-)= c(H+)+2c(H2C2O4)+c(HC2O4-) D.c(H2C2O4)+c(C2O42-)+c(HC2O4-)=0.02mol/L
(5)甲同学按照图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象____________________,由此可知草酸晶体分解的产物中有__________________________。装置B的主要作用是_______________________________。

(6)设计实验证明:
①草酸的酸性比碳酸的强_________________________________________________________。
②草酸为二元酸_________________________________________________________________。
【答案】H2C2O4 ![]() HC2O4-+H+ 、HC2O4-
HC2O4-+H+ 、HC2O4-![]() H+ + C2O42- CO32- + H2O
H+ + C2O42- CO32- + H2O ![]() HCO3- + OH- 小 B 有气泡产生,澄清石灰水变浑浊 CO2 冷凝分解产物中的水和草酸,防止其进入C 干扰CO2的检验 向1mol/L的NaHCO3溶液中加入1mol/L的草酸溶液,若产生大量气泡则说明草酸的酸性比碳酸强 用NaOH标准溶液滴定草酸溶液,消耗NaOH的物质的量是草酸的2倍
HCO3- + OH- 小 B 有气泡产生,澄清石灰水变浑浊 CO2 冷凝分解产物中的水和草酸,防止其进入C 干扰CO2的检验 向1mol/L的NaHCO3溶液中加入1mol/L的草酸溶液,若产生大量气泡则说明草酸的酸性比碳酸强 用NaOH标准溶液滴定草酸溶液,消耗NaOH的物质的量是草酸的2倍
【解析】
(1).由题中信息可知,草酸为二元弱酸,在水溶液中分两步电离,电离方程式为H2C2O4 ![]() HC2O4-+H+ 、HC2O4-
HC2O4-+H+ 、HC2O4-![]() H+ + C2O42-,故答案为:H2C2O4
H+ + C2O42-,故答案为:H2C2O4 ![]() HC2O4-+H+ 、HC2O4-
HC2O4-+H+ 、HC2O4-![]() H+ + C2O42-;
H+ + C2O42-;
(2).碳酸根离子发生水解CO32-+ H2O ![]() HCO3- + OH-使溶液呈碱性,加入酚酞试剂后溶液显红色,故答案为:CO32-+ H2O
HCO3- + OH-使溶液呈碱性,加入酚酞试剂后溶液显红色,故答案为:CO32-+ H2O ![]() HCO3- + OH-;
HCO3- + OH-;
(3).草酸的第二步电离平衡常数大于碳酸的第二步电离平衡常数,电离平衡常数越小,其酸根离子的水解程度越大,所以碳酸根离子的水解程度大于草酸根离子的水解程度,则相同条件下等物质的量浓度的草酸钠溶液pH小于碳酸钠溶液的pH,故答案为:小;
(4). 向1L 0.02mol/L H2C2O4溶液中滴加1L 0.01mol/L NaOH溶液,反应得到等物质的量浓度的H2C2O4和NaHC2O4溶液,混合溶液中c(H+)>c(OH-),说明H2C2O4的电离程度大于HC2O4-的水解程度。
A. H2C2O4的电离程度大于HC2O4-的水解程度,则溶液中c(H2C2O4)<c(HC2O4-),故A错误;
B. 由电荷守恒可知,c(Na+)+c(H+)=2c(C2O42-)+ c(HC2O4-)+c(OH-),故B正确;
C.溶液呈酸性,则c(OH-)< c(H+),所以c(OH-)<c(H+)+2c(H2C2O4)+c(HC2O4-),故C错误;
D. 由物料守恒可知,c(H2C2O4)+c(C2O42-)+c(HC2O4-)=0.01mol/L,故D错误,答案选B;
(5).草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解,如果草酸受热分解,分解时会产生二氧化碳,二氧化碳和氢氧化钙反应生成难溶于水的碳酸钙沉淀而使澄清石灰水变浑浊,所以C中观察到的现象是:有气泡冒出且澄清石灰水变浑浊;草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水,草酸易挥发,导致生成的气体中含有草酸,草酸和氢氢化钙反应生成难溶性的草酸钙而干扰二氧化碳的检验,B装置温度较低,有冷凝作用,防止干扰二氧化碳的检验,故答案为:有气泡冒出,澄清石灰水变浑浊;CO2;冷凝分解产物中的水和草酸,防止其进入C 干扰CO2的检验;
(6). ①. 要证明草酸的酸性大于碳酸,可以利用强酸制弱酸的原理,向盛有1mol/L NaHCO3溶液的试管里滴加1mol/L的草酸溶液,有气泡产生就说明草酸的酸性大于碳酸,故答案为:向1mol/L的NaHCO3溶液中加入1mol/L的草酸溶液,若产生大量气泡则说明草酸的酸性比碳酸强;
②.草酸和NaOH发生中和反应时,如果草酸是二元酸,则参加反应的草酸物质的量应该是NaOH的一半,所以用NaOH标准溶液滴定草酸溶液,消耗NaOH的物质的量是草酸的2倍就说明草酸是二元酸,故答案为:用NaOH标准溶液滴定草酸溶液,消耗NaOH的物质的量是草酸的2倍;

【题目】化学兴趣A组的同学们利用废硫酸溶液制备K2SO4晶体,设计流程如下图所示:
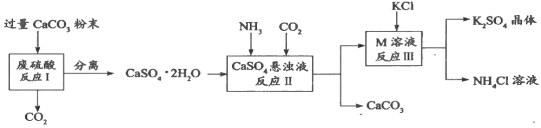
(1)写出反应Ⅰ的化学方程式:______________________。
(2)反应Ⅱ生成了一种可用作肥料的物质M,M的化学式为_________________。
(3)上述流程中可循环使用的物质有CO2和_________(填化学式)。
(4)反应Ⅲ中相关物质在25℃时的溶解度如下表。
物质 |
|
|
|
|
溶解度/g | 34.0 | 11.1 | 37.2 | 19.5 |
反应Ⅲ在常温下(25℃)能实现的原因是_________________________。
(5)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的原因是_____________;为了检验此晶体是否洗涤干净,取最后一次洗涤液于试管中,先加入过量的_______(选填字母),振荡、静置, 再向上层清液中滴加_______(选填字母),观察现象即可判断该晶体是否洗涤干净。
A. AgNO3溶液 B. BaCl2溶液 C. Ba(NO3)2溶液 D .Ba(OH)2溶液 E. NaOH溶液
【题目】下列因果关系不正确的是( )
选项 | 原因 | 结果 |
A | 大量植树造林 | 温室效应 |
B | SO2和NO2气体的大量排放 | 酸雨 |
C | 含氮、磷等生活废水的大量排放 | 水华、赤潮 |
D | 汽车尾气的大量排放 | 光化学烟雾 |
A. AB. BC. CD. D