题目内容
10. 元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.(1)Cl2的电子式是
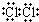 .新制的氯水可用于漂白,工业上将氯气制成漂白粉的目的是漂白粉比次氯酸稳定,便于储存和运输,漂白粉是一种混合物(填“混合物”或“纯净物”)
.新制的氯水可用于漂白,工业上将氯气制成漂白粉的目的是漂白粉比次氯酸稳定,便于储存和运输,漂白粉是一种混合物(填“混合物”或“纯净物”)(2)碘元素在元素周期表中的位置是第五周期ⅦA族;为防缺碘,食盐中常添加碘酸钾,该物质内存在离子键、共价键键(填化学键类型).
(3)溴单质是唯一常温下呈液态的非金属单质,液溴的保存通常采取的方法是水封在棕色瓶中,密闭保存.
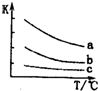
(4)已知:X2(g)+H2(g)2HX(g) (X2表示Cl2、Br2和I2).如图表示平衡常数K与温度T的关系.
①△H表示X2与H2反应的焓变,△H<0.(填“>”、“<”或“=”)
②曲线a表示的是I2(填“Cl2”、“Br2”或“I2”)与H2反应时K与T的关系.
分析 (1)氯原子最外层有7个电子,形成稳定结构,氯与氯之间形成一对共用电子对,次氯酸钙的稳定性比次氯酸强,漂白粉是次氯酸钙与氯化钙的混合物;
(2)碘元素第五周期的卤族元素;碘酸钾是含有共价键的离子化合物;
(3)液溴易挥发,而挥发性的物质用水封在棕色瓶中密闭保存;
(4)依据图象分析平衡常数随温度升高减小,说明平衡逆向进行,正反应为放热反应;Cl2、Br2、I2,与H2反应时K与t的关系分析可知氯气和氢气反应放热多.
解答 解:(1)Cl2的电子式是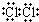 ,新制的氯水可用于漂白,盐比酸稳定,所以工业上将氯气制成漂白粉,漂白粉是次氯酸钙与氯化钙的混合物,
,新制的氯水可用于漂白,盐比酸稳定,所以工业上将氯气制成漂白粉,漂白粉是次氯酸钙与氯化钙的混合物,
故答案为: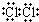 ; 漂白粉比次氯酸稳定,便于储存和运输;混合物;
; 漂白粉比次氯酸稳定,便于储存和运输;混合物;
(2)碘元素第五周期的卤族元素;碘酸钾中有离子键和共价键,故答案为:第五周期ⅦA族;离子键、共价键;
(3)中学阶段中见光易分解放在棕色瓶中和易挥发的物质用水封在棕色瓶中,密闭保存,故答案为:水封在棕色瓶中,密闭保存;
(4)①图象分析平衡常数随温度升高减小,说明平衡逆向进行,正反应为放热反应,△H<0,故答案为:<;
②Cl2、Br2、I2,与H2反应时K与T的关系分析可知氯气和氢气反应放热多,碘化氢加热分解平衡逆向进行平衡常数减小的大,曲线a表示的是I2,故答案为:I2.
点评 本题考查了电子式、漂白粉的成份、元素在周期表中位置等,综合性强,学生只要掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
18.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
| X | Y | ||
| W | Z |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性 | |
| D. | X的阴离子比Y的阴离子离子半径大 |
19.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1mol C(金刚石)中含有C-C键的数目为4NA | |
| B. | 标准状况下,22.4L乙烯中含有σ键的数目为5NA | |
| C. | 含0.2moi H2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目为0.1NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极得到电子的数目为NA |
16. 25℃时,用0.1000mol•L-1的NaOH溶液滴定20mL 0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示,下列说法不正确的是( )
25℃时,用0.1000mol•L-1的NaOH溶液滴定20mL 0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示,下列说法不正确的是( )
 25℃时,用0.1000mol•L-1的NaOH溶液滴定20mL 0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示,下列说法不正确的是( )
25℃时,用0.1000mol•L-1的NaOH溶液滴定20mL 0.1000mol•L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示,下列说法不正确的是( )| A. | 可用酚酞作该滴定的指示剂 | |
| B. | 当溶液中c(H+)+c(OH-)=2×10-7时,c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 当滴定到pH=4.75时,c(A-)>c(Na+)>c(HA) | |
| D. | 当滴入40mL NaOH溶液时,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
5.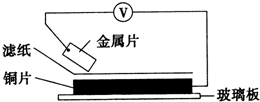 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( )
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( )
 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( )
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)依据记录数据判断,下列结论中正确的是( ) | 金属 | 电子流动方向 | 电压(V) |
| 甲 | 甲→Cu | +0.78 |
| 乙 | Cu→乙 | -0.15 |
| 丙 | 丙→Cu | +1.35 |
| 丁 | E→Cu | +0.30 |
| A. | 金属乙能从硫酸铜溶液中置换出铜 | |
| B. | 甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀 | |
| C. | 在四种金属中乙的还原性最强 | |
| D. | 甲、丁若形成原电池时,甲为正极 |
15.下列溶液加热蒸干并灼烧后,能析出与原溶液相同的溶质固体的是( )
| A. | FeCl2 | B. | KHCO3 | C. | MgSO4 | D. | NH4HCO3 |
19.下列变化过程需加入氧化剂的是( )
| A. | HCl→H2 | B. | Mg→Mg2+ | C. | Cl-→AgCl | D. | CuO→Cu |
20.饱和烃A和不饱和烃B在常温下均为气体(碳原子数不大于4),其中A分子中含有碳原子数多于B.
(1)将A和B按一定比例混合.1L混合气体完全燃烧后在同温、同压下得到3.6LCO2.试推断该混合气体的可能组合及A与B混合时的体积比.将结果填入下表.
(2)120℃时,1LA、1LB与足量氧气混合点燃后,在同温、同压下总体积增大2L.试通过计算确定A和B的分子式.
(1)将A和B按一定比例混合.1L混合气体完全燃烧后在同温、同压下得到3.6LCO2.试推断该混合气体的可能组合及A与B混合时的体积比.将结果填入下表.
| 编号 | A的分子式 | B的分子式 | VA:VB |
| ① | C4H10 | C3H6 | 3:2 |
| ② | C4H10 | C2H4 | 4:1 |
| ③ | C4H10 | C2H2 | 4:1 |
| ④ | C4H10 | C3H4 | 3:2 |
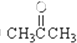 ③CH3CH2Br④
③CH3CH2Br④ ⑤
⑤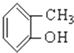 ⑥
⑥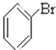 ⑦
⑦ ⑧
⑧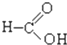 ⑨
⑨ ⑩
⑩