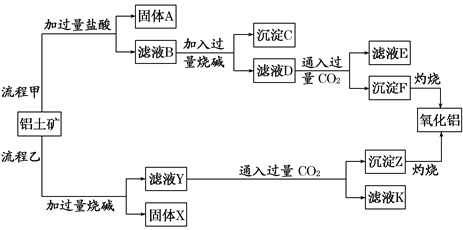
题目内容
【题目】Ⅰ.(1) 恒温恒容时,下列能说明合成氨反应达到平衡状态的是_________。
a.容器内N2、H2、NH3的浓度之比为1:3:2
b. v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变
d.混和气体的密度保持不变
e.单位时间内断裂6molN-H键的同时,有3molH-H形成
f.混合气体的平均分子量不变
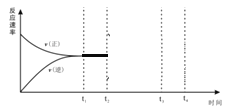
Ⅱ.(2)在恒温恒压密闭容器中充入1molN2和3molH2在t1时刻达到平衡状态后,t2时继续充入2mol NH3,t3时达到平衡,在下图中画出v(正)和v(逆) 在t2到t4间的变化曲线_________。
Ⅱ.由合成气(组成为H2、CO和少量的CO2) 直接制备二甲醚,涉及如下反应。
甲醇合成反应: _____
(ⅰ)时CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ·mol-1二甲醚合成反应
CH3OH(g) △H1=-90.1kJ·mol-1二甲醚合成反应
(ⅱ)2CH3OH(g)![]() CH3OCH(g)+H2O(g) △H2=-23.9 kJ·mol-1
CH3OCH(g)+H2O(g) △H2=-23.9 kJ·mol-1
(ⅲ)2CH3OH(g)![]() C2H4(g)+2H2O(g) △H3=-29.1kJ·mol-1
C2H4(g)+2H2O(g) △H3=-29.1kJ·mol-1
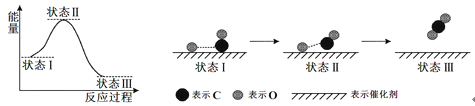
(1)二甲醚合成反应过程中两反应能量变化如图所示:
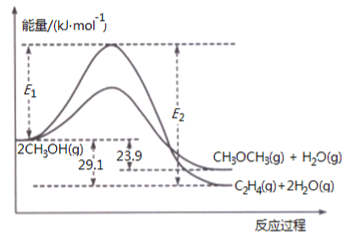
①反应速率较大的是__________(填序号“ⅱ”、“ⅲ”),说明原因________________。
②若在容器中加入催化剂,则E2-E1将__________(填“变大”、“ 不变”或“变小”)。
(2)Kp是用平衡分压代替平衡浓度所得的平衡常数,分压=总压×物质的量分数。一定温度时,向容器中充入2molH2和1molCO,反应(ⅰ) 达平衡状态时,总气体的物质的量为2mol,总压强为2×105pa,则KP___________为(需要带单位)
【答案】 c f 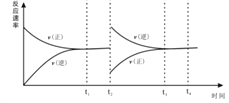 ⅱ 反应活化能低 不变 10-10pa-2
ⅱ 反应活化能低 不变 10-10pa-2
【解析】Ⅰ(1)a.容器内N2、H2、NH3浓度比与起始浓度及转化率有关,平衡时不一定等于化学计量数之比,故a错误;b.平衡时不同物质表示的正逆速率之比等于化学计量数之比,应是3v(N2)正=v(H2)逆时反应到达平衡状态,故b错误;c.随反应进行,混合气体物质的量变化,容器内压强发生变化,压强保持不变说明到达平衡,故c正确;d.混合气体总质量不变,容器容积不变,混合气体密度始终保持不变,故d错误;e.断裂6molN-H键的同时,有3molH-H形成都是正反应方向,故e错误;f.混合气体总质量不变,随反应进行,混合气体物质的量变化,则平均摩尔质量变化,若混合气体平均摩尔质量保持不变,说明到达平衡,故f正确,故选:cf;
(2)容器为恒温恒压密闭容器,当充入2mol NH3时,生成物的浓度增大,反应物的浓度减小,所以v(正)变小,v(逆)增大,故图像为
Ⅱ(1)①活化能越小,反应速率越大。所以反应速率较大的反应是ii。②催化剂可以降低反应所需的活化能,所以最高点下降,但是起终点不变,E2-E1表示的是焓变的负值,△H不变。
(2)
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
1 2 0
x 2x x
1-x 2-2x x
1-x+2+2x+x=2mol 解得x= 0.5mol
根据分压=总压×物质的量分数,得出KP=p(CH3OH)/p(CO)p2(H2)= 10-10pa-2