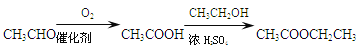题目内容
【题目】铁和铁的化合物在工业生产和日常生活中都有广泛的用途。请回答下列问题:
(1)钢铁锈蚀是目前难以解决的现实问题,电化学腐蚀最为普遍。写出在潮湿空气中钢铁锈蚀时发生还原反应的电极反应式:________________________________。
铁锈的主要成分是____________(填写化学式),将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:_____________________。
(2)爱迪生蓄电池的反应式为Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。
Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。
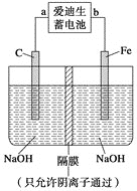
①此装置中爱迪生蓄电池的负极是________(填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是__________。
②写出在用电解法制取高铁酸钠时,阳极的电极反应式__________________________。
③你认为高铁酸钠作为一种新型净水剂的理由可能是______。
A.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
B.高铁酸钠具有强氧化性,能消毒杀菌
C.高铁酸钠在消毒杀菌时被还原生成Fe3+,水解产生氢氧化铁胶体能吸附悬浮杂质
【答案】 O2+4e-+2H2O===4OH- Fe2O3·xH2O 2Fe3++Fe===3Fe2+ a 氧化反应 Fe-6e-+8OH-===FeO![]() +4H2O BC
+4H2O BC
【解析】1)钢铁在潮湿的空气中发生吸氧腐蚀,正极上氧气得电子和水反应生成氢氧根离子O2+4e-+2H2O===4OH-;亚铁离子与氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁被氧气氧化为氢氧化铁,氢氧化铁失去部分水,即为铁锈的主要成分,因此铁锈的主要成分为Fe2O3·xH2O;铁和铁离子能发生氧化还原反应生成亚铁离子,离子方程式为: 2Fe3++Fe===3Fe2+,导致溶液中不存在铁离子;正确答案: O2+4e-+2H2O===4OH- ; Fe2O3·xH2O ;2Fe3++Fe===3Fe2+。
(2)①放电时,铁作负极,碳棒作正极,所以放电时a是负极,b是正极;充电时,氢氧化镍失电子生成氧化镍,发生氧化反应;正确答案: a; 氧化反应。
②阳极上铁失电子和氢氧根离子反应生成高铁酸根离子和水,离子方程式为: Fe-6e-+8OH-===FeO![]() +4H2O ;正确答案: Fe-6e-+8OH-===FeO
+4H2O ;正确答案: Fe-6e-+8OH-===FeO![]() +4H2O 。
+4H2O 。
③高铁酸钠具有强氧化性,所以能杀菌消毒;高铁酸钠能被还原生成铁离子,铁离子能水解生成氢氧化铁胶体,胶体具有吸附性,能吸附悬浮杂质,所以能净水,所以BC选项是正确的;正确选项BC。