题目内容
【题目】MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2 (含有较多的MnO 和MnCO3) 样品转化为纯MnO2的实验,其流程如下:

(1)第①步加稀H2SO4时,粗MnO2样品中的________(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式:___________________________________。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、______、______、______,己知蒸发得到的固体中有NaClO3 和NaOH,则一定还有含有________(写化学式)。
(4)若粗MnO2样品的质量为12.69g,第①步反应后,经过滤得到8.7g MnO2,并收集到0.224LCO2 (标准状况下),则在第②步反应中至少需要___molNaClO3。
【答案】MnO和MnCO3 5Mn2++2ClO3﹣+4H2O=5MnO2+Cl2↑+8H+ 酒精灯 蒸发皿 玻璃棒 NaCl 0.02
【解析】
(1)由制备流程可以知道, 样品中的MnO2不溶于硫酸, MnO和MnCO3都能够与硫酸反应生成锰离子;正确答案:MnO和MnCO3。
(2)根据流程可知:滤液中含有Mn2+,氯酸钠具有强氧化性,二者反应,Mn2+被氧化为MnO2,氯酸钠被还原为氯气,离子方程式5Mn2++2ClO3﹣+4H2O=5MnO2+Cl2↑+8H+;正确答案: 5Mn2++2ClO3﹣+4H2O=5MnO2+Cl2↑+8H+。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、酒精灯、蒸发皿、玻璃棒;氯气通入热的NaOH溶液中一定发生氧化还原反应,且氯气既做氧化剂又做还原剂, NaClO3属于氧化产物,因此一定有还原产物NaCl;正确答案:酒精灯、蒸发皿、玻璃棒; NaCl 。
(4)根据题意可知,MnO和MnCO3混合物质量为12.69-8.7=3.99 g;能够与硫酸反应生成CO2的为MnCO3,当产生CO2为0.01mol时,消耗MnCO3的量为0.01mol,质量为0.01×115=1.15 g,则MnO的质量为3.99-1.15=2.84 g,物质的量为2.84/71=0.04 mol;根据反应规律:,Mn2+被氧化为MnO2,氯酸钠被还原为氯气,设第②步反应中至少需要x molNaClO3。根据电子守恒规律:(0.04+0.01)×2=x×5,x=0.02mol;正确答案:0.02。

【题目】Mg、Al、Si、Cu是常用的生活材料。请回答下列问题:
(1)基态Cu2+中电子占有的能级数目是_______________。
(2)Mg、A1元素及其化合物有以下性质:
Mg元素及其化合物 | Al元素及其化合物 | |
电离能/(KJ/mol) | Mg:I1=738.14,I2=1451,I3=7733 | Al:I1=578,I2=1817,I3=2745 |
熔点/℃ | MgCl2:714 | AlCl3:190(2.5×105Pa) |
①Mg原子的配位数是12,属于__堆积方式解释第一电离能Mg比Al大的原因:_______________。
②解释熔点MgCl2比AlCl3高的原因:_______________。
③资料表明铝的氧化物分子式是Al2Cl6,其中Al的杂化方式是_____,从共用电子对提供的角度可知该分于中存在的化学键类型是_________.
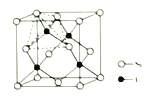
(3)金刚砂(SiC)的晶胞结构如图,若NA表示阿伏加德罗常数的值,晶体的密度是ρg/cm3,则Si原子的半径R为__cm(不必化简)。
【题目】氨气是重要化工原料,在国民经济中占重要地位。工业合成氨的反应为:N2(g)+3H2(g)![]() 2NH3(g) △H<0进行如下研究:在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3) 与反应时间t的关系如下表:
2NH3(g) △H<0进行如下研究:在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3) 与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2) /mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3) /mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(1)反应速率最快的时间段是__________
A.0min-5min B .5min-10min C.10min-15min D. 15min-20min
(2)该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3mol/L、3mol/L、3mol/L,则此时v正 __________v逆 (填 “>”“<”或“=”)。
(3)NH3合成常见的化肥尿素【化学式为CO(NH2)2】分为三步,其中第一步为:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H=-160kJ/mol, 对于这个反应,在2L等容密闭容器中充入2molNH3和1molCO2,平衡时放出128kJ的热量,NH3 的转化率为__________若反应温度不变,在该容器中充入2.8molNH3和1.4molCO2,到达平衡时。c(NH3)为__________。
NH2COONH4(s) △H=-160kJ/mol, 对于这个反应,在2L等容密闭容器中充入2molNH3和1molCO2,平衡时放出128kJ的热量,NH3 的转化率为__________若反应温度不变,在该容器中充入2.8molNH3和1.4molCO2,到达平衡时。c(NH3)为__________。
(4)以氨气代替氢气研发氨燃料电池是当前科研的一个热点。
①氨燃料电池使用的电解质溶液是4mol·L-1的KOH溶液,电池反应为: 4NH3+3O2=2N2+6H2O。该反应每消耗3.4g NH3转移的电子数目为__________;
②氨燃料电池电解CuSO4溶液,如图所示,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,然后向所得溶液中加入19.6gCu(OH)2固体后恰好可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为__________L。