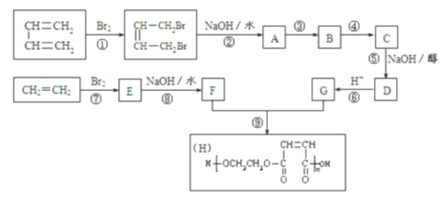
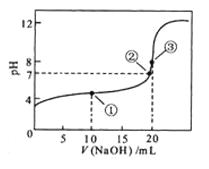
题目内容
【题目】甲醇水蒸气重整制氢方法是目前比较成熟的制氢方法,且具有良好的应用前景。甲醇水蒸气重整制氢的部分反应过程如图所示:
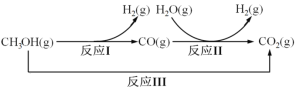
(1)已知一定条件下
反应I:CH3OH(g)==CO(g)+2H2(g) ΔH1=+90.7kJ/mol
反应III:CH3OH(g)+H2O(g) =CO2(g)+3H2(g) ΔH3=+49.5kJ/mol
该条件下反应II的热化学方程式是___。
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率见图。
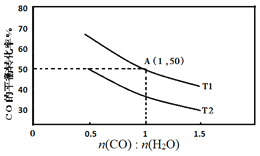
①比较T1、T2的大小,并解释原因___。
②A点对应的化学平衡常数是___。
③T1温度时,按下表数据开始反应建立平衡。
CO | H2O | H2 | CO2 | |
起始浓度(mol/L) | 2 | 1 | 0 | 0 |
t时刻浓度(mol/L) | 1.2 | 0.2 | 0.8 | 0.8 |
反应进行到t时刻时,判断v(正)、v(逆)的大小关系为:v(正)__v(逆)(填“>”“<”或“=”)。
④当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是___。
(3)在经CO2饱和处理的KHCO3电解液中,电解活化CO2可以制备乙醇,原理如图所示。
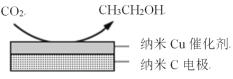
①阴极的电极反应式是___。
②从电解后溶液中分离出乙醇的操作方法是___。
【答案】H2O(g)+CO(g)=H2(g)+CO2(g) ΔH=-41.2kJ·mol-1 T1<T2,该反应(或者反应II)的ΔH<0,升高温度平衡逆向移动;图像表明,进气比相同时,温度由T1变为T2时CO转化率减小,平衡逆向移动,可知T1<T2 1 v(正)<v(逆) 进气比越大,反应温度越低 2CO2+12e-+12H+=CH3CH2OH+3H2O 蒸馏
【解析】
(1)由题目所给反应过程图可知,反应II为H2O(g)+CO(g)=H2(g)+CO2(g),根据盖斯定律,可知反应II=反应III-反应I,则该反应的ΔH=-41.2kJ·mol-1;
(2)①该反应(或者反应II)的ΔH<0,升高温度平衡逆向移动;图像表明,进气比相同时,温度由T1变为T2时CO转化率减小,平衡逆向移动,可知T1<T2;
②根据题目所给信息可列三段式

则反应平衡常数K=![]() ;
;
③t时刻时,![]() ,所以v(正)<v(逆);
,所以v(正)<v(逆);
④根据题目信息可知进气比越大,反应温度越低;
(3)①阴极2CO2放电,电极反应式为2CO2+12e-+12H+=CH3CH2OH+3H2O;
②电解后溶液中分离出乙醇的操作方法是蒸馏

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案