题目内容
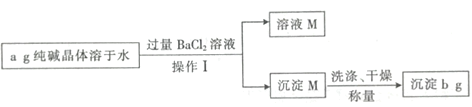
【题目】纯碱晶体![]() 样品中常混有NaCl等杂质。某同学用沉淀法测定样品中
样品中常混有NaCl等杂质。某同学用沉淀法测定样品中![]() 的质量分数,操作流程如下:
的质量分数,操作流程如下:
(1)写出加入![]() 溶液反应的离子方程式____;操作I所用到的玻璃仪器有烧杯、玻璃棒、____。
溶液反应的离子方程式____;操作I所用到的玻璃仪器有烧杯、玻璃棒、____。
(2)对沉淀M洗涤的方法是___。
(3)样品中![]() 的质量分数为___。
的质量分数为___。
(4)如果纯碱晶体失去部分结晶水(风化),则测定结果会___(填“偏高”、“偏低”或“不变”)。
(5)纯碱在生产生活中有广泛应用,用途正确的是_____。
A 用于治疗胃酸过多 B 用于生产玻璃 C 用于造纸 D 用于焙制糕点
【答案】CO32-+Ba2+=BaCO3↓ 漏斗 沿玻璃棒向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复操作2~3次,直至洗涤干净即可 ![]() % 偏高 BC
% 偏高 BC
【解析】
根据流程图可知,纯碱晶体样品中常混有NaCl等杂质,溶于水后形成碳酸钠与氯化钠的混合溶液,加入过量氯化钡溶液,碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,经过滤操作得沉淀M为碳酸钡,溶液M为氯化钠与氯化钡的混合溶液,据此回答。
根据流程图可知,纯碱晶体样品中常混有NaCl等杂质,溶于水后形成碳酸钠与氯化钠的混合溶液,加入过量氯化钡溶液,碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠,经过滤操作得沉淀M为碳酸钡,溶液M为氯化钠与氯化钡的混合溶液;
(1)碳酸钠与氯化钡反应的离子方程式为:CO32-+Ba2+=BaCO3↓,操作Ⅰ为过滤,用到的玻璃仪器有烧杯、玻璃棒和漏斗;故答案为:CO32-+Ba2+=BaCO3↓;漏斗;
(2)洗涤沉淀的方法是:沿玻璃棒向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复操作2~3次,直至洗涤干净即可;故答案为:沿玻璃棒向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复操作2~3次,直至洗涤干净即可;
(3)由分析可知,碳酸钡质量为bg,n(BaCO3)=![]() =
=![]() mol,则n(Na2CO3)= n(BaCO3)=
mol,则n(Na2CO3)= n(BaCO3)=![]() mol,m(Na2CO3)=
mol,m(Na2CO3)=![]() mol
mol![]() =
=![]() g,质量分数为:
g,质量分数为: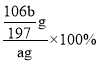 =
=![]() %;故答案为:
%;故答案为:![]() %;
%;
(4)如果纯碱晶体失去部分结晶水,则样品质量偏小,会导致测定结果偏高;故答案为:偏高;
(5)纯碱主要应用于玻璃制造业、化学工业、冶金工业、以及造纸、肥皂、纺织、印染、食品等轻工业,小苏打可以用于治疗胃酸过多和焙制糕点,故答案为:BC。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】甲醇水蒸气重整制氢方法是目前比较成熟的制氢方法,且具有良好的应用前景。甲醇水蒸气重整制氢的部分反应过程如图所示:
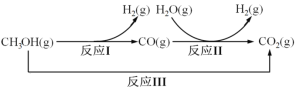
(1)已知一定条件下
反应I:CH3OH(g)==CO(g)+2H2(g) ΔH1=+90.7kJ/mol
反应III:CH3OH(g)+H2O(g) =CO2(g)+3H2(g) ΔH3=+49.5kJ/mol
该条件下反应II的热化学方程式是___。
(2)已知反应II在进气比[n(CO):n(H2O)]不同时,在不同温度(T1、T2)下,测得相应的CO的平衡转化率见图。
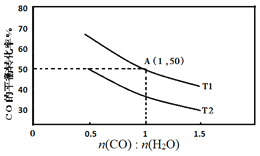
①比较T1、T2的大小,并解释原因___。
②A点对应的化学平衡常数是___。
③T1温度时,按下表数据开始反应建立平衡。
CO | H2O | H2 | CO2 | |
起始浓度(mol/L) | 2 | 1 | 0 | 0 |
t时刻浓度(mol/L) | 1.2 | 0.2 | 0.8 | 0.8 |
反应进行到t时刻时,判断v(正)、v(逆)的大小关系为:v(正)__v(逆)(填“>”“<”或“=”)。
④当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是___。
(3)在经CO2饱和处理的KHCO3电解液中,电解活化CO2可以制备乙醇,原理如图所示。
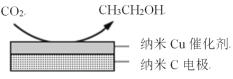
①阴极的电极反应式是___。
②从电解后溶液中分离出乙醇的操作方法是___。