题目内容
【题目】请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化后气化的方法提纯,其除杂质过程为把杂质用热的重铬酸钾(K2Cr2O7)酸性溶液浸泡发生反应,溶液逐渐变成浅绿色(Cr3+),同时产生使澄清石灰水变浑浊的气体,写出反应的离子方程式:____________________________________________。
(2)焦炭可用于制取水煤气。测得24g碳与水蒸气完全反应生成水煤气时,吸收了263.2kJ热量。该反应的热化学方程式为_________________________________。
(3)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为CO(g)+2H2(g) ![]() CH3OH(g) △H1=-116kJ·mol-1。
CH3OH(g) △H1=-116kJ·mol-1。
①下列措施有利于提高反应物转化率的是___________(填序号)。
A.及时将CH3OH与反应混合物分离 B.降低反应温度
C.减小体系压强 D.使用高效催化剂
②乙醇电池具有很高的实用价值。如右图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。该电池的负极反应式为_________________________________。

③已知:CO(g)+![]() O2(g)=CO2(g) △H2=-283 kJ·mol-1
O2(g)=CO2(g) △H2=-283 kJ·mol-1
H2(g)+ ![]() O2(g)=H2O(g) △H3=? kJ·mol-1
O2(g)=H2O(g) △H3=? kJ·mol-1
1mol气态甲醇完全燃烧生成CO2和水蒸气时放出热量651kJ,则△H3=________________。
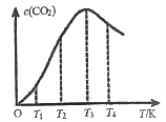
④在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律,如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答下列问题:

(i)在上述三种温度中,曲线X对应的温度是______________________。
(ii)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K=___________。
CH3OH(g)的平衡常数K=___________。
(4)CO2经常用氢氧化钠溶液来吸收,现有0.2moCO2,若用100mL3 mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为______________________。
【答案】2Cr2O72-+ 3C+16H+=4Cr3++3CO2↑+8H2O C(s)+H2O(g)=CO(g)+H2(g) △H= +131.6kJ/mol AB CH3CH2OH+H2O-4e-=CH3COOH+4H+ -242kJmol-1 230℃ 4 c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
【解析】
(1)使澄清石灰水变浑浊的气体是CO2,反应中碳元素化合价由0价升高到+4价,Cr元素从+6价降低到+3价,所以Cr2O72-作氧化剂,对应产物Cr3+,C作还原剂,对应产物CO2,要使氧化剂得到电子总数等于还原剂失去电子总数,则C系数为3,Cr2O72-系数为2,根据原子守恒和电荷守恒,反应的离子方程式为2Cr2O72-+ 3C+16H+=4Cr3++3CO2↑+8H2O。
(2)24g碳的物质的量为2mol,与水蒸气完全反应生成水煤气(CO、H2),吸收了263.2kJ热量。该反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g) △H= +131.6kJ/mol。
(3)①CO(g)+2H2(g) ![]() CH3OH(g) △H1=-116kJ·mol-1;
CH3OH(g) △H1=-116kJ·mol-1;
A.及时将CH3OH与反应混合物分离,使得平衡正向移动,有利于提高反应物转化率;
B.该反应正反应是放热反应,降低反应温度,平衡正向移动,有利于提高反应物转化率; C.减小体系压强,平衡逆向移动,不利于提高反应物转化率;
D.使用高效催化剂,不能使平衡移动,故反应物转化率不变;
②乙醇燃料电池中,负极上乙醇失去电子发生氧化反应生成CH3COOH,负极反应式为CH3CH2OH+H2O-4e-=CH3COOH+4H+。
③1mol气态甲醇完全燃烧生成CO2和水蒸气时放出热量651kJ,可知④CH3OH(g)+3/2 O2(g)= CO2(g)+2H2O(g),△H=-651kJ·mol-1,根据反应①CO(g)+2H2(g) ![]() CH3OH(g) △H1=-116kJ·mol-1,②CO(g)+
CH3OH(g) △H1=-116kJ·mol-1,②CO(g)+![]() O2(g)=CO2(g) △H2=-283 kJ·mol-1,根据盖斯定律,(④+①-②)/2,可得H2(g)+
O2(g)=CO2(g) △H2=-283 kJ·mol-1,根据盖斯定律,(④+①-②)/2,可得H2(g)+ ![]() O2(g)=H2O(g)△H3=-242kJmol-1。
O2(g)=H2O(g)△H3=-242kJmol-1。
④(i)根据反应CO(g)+2H2(g) ![]() CH3OH(g) △H1=-116kJ·mol-1,是放热反应,温度越低,转化率越高,所以曲线X对应的温度是230℃。
CH3OH(g) △H1=-116kJ·mol-1,是放热反应,温度越低,转化率越高,所以曲线X对应的温度是230℃。
(ii) a点时,CO的转化率为50%,反应消耗了1mol×50%=0.5molCO,消耗氢气1mol,生成0.5mol甲醇,剩余0.5molCO,n(H2)=0.5mol, a点平衡时各组分的浓度是c(CH3OH)=0.5mol/L,c(CO)=0.5mol/L,c(H2)=0.5mol/L,则K= c(CH3OH)/ [c(CO) c2(H2)]=![]() =4。
=4。
(4)根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠,0.2moCO2和100mL3 mol/LNaOH溶液混合,二者的物质的量之比为2:3,所以溶液是物质的量浓度相等的碳酸钠和碳酸氢钠的混合液,混合液显碱性,c(OH-)>c(H+);由于碳酸根离子水解程度大于碳酸氢根离子的水解程度,所以c(HCO3-)>c(CO32-),即c(Na+)>c(HCO3-)>c (CO32-)>c(OH-)>c(H+)。
(1)使澄清石灰水变浑浊的气体是CO2,反应中碳元素化合价由0价升高到+4价,Cr元素从+6价降低到+3价,所以Cr2O72-作氧化剂,对应产物Cr3+,C作还原剂,对应产物CO2,要使氧化剂得到电子总数等于还原剂失去电子总数,则C系数为3,Cr2O72-系数为2,根据原子个数守恒,反应的离子方程式为2Cr2O72-+ 3C+16H+=4Cr3++3CO2↑+8H2O,故答案为:2Cr2O72-+ 3C+16H+=4Cr3++3CO2↑+8H2O。
(2)24g碳的物质的量为2mol,与水蒸气完全反应生成水煤气(CO、H2),吸收了263.2kJ热量,该反应的热化学方程式为C(s)+H2O(g)=CO(g)+H2(g) △H= +131.6kJ/mol,故答案为:C(s)+H2O(g)=CO(g)+H2(g) △H= +131.6kJ/mol。
(3)①CO(g)+2H2(g) ![]() CH3OH(g) △H1=-116kJ·mol-1,
CH3OH(g) △H1=-116kJ·mol-1,
A.及时将CH3OH与反应混合物分离,使得平衡正向移动,有利于提高反应物转化率,故A正确;
B.该反应正反应是放热反应,降低反应温度,平衡正向移动,有利于提高反应物转化率,故B正确;
C.减小体系压强,平衡逆向移动,不利于提高反应物转化率,故C错误;
D.使用高效催化剂,不能使平衡移动,故反应物转化率不变,故D错误;
故选AB。
②乙醇燃料电池中,负极上乙醇失去电子发生氧化反应生成CH3COOH,负极反应式为CH3CH2OH+H2O-4e-=C3COOH+4H+,故答案为:CH3CH2OH+H2O-4e-=CH3COOH+4H+。
③1mol气态甲醇完全燃烧生成CO2和水蒸气时放出热量651kJ,可知④CH3OH(g)+3/2 O2(g)= CO2(g)+2H2O(g),△H=-651kJ·mol-1,根据反应①CO(g)+2H2(g) ![]() CH3OH(g) △H1=-116kJ·mol-1,②CO(g)+
CH3OH(g) △H1=-116kJ·mol-1,②CO(g)+![]() O2(g)=CO2(g) △H2=-283 kJ·mol-1,根据盖斯定律,(④+①-②)/2,可得H2(g)+
O2(g)=CO2(g) △H2=-283 kJ·mol-1,根据盖斯定律,(④+①-②)/2,可得H2(g)+ ![]() O2(g)=H2O(g)△H3=-242kJmol-1,故答案为:-242kJmol-1。
O2(g)=H2O(g)△H3=-242kJmol-1,故答案为:-242kJmol-1。
④(i)根据反应CO(g)+2H2(g) ![]() CH3OH(g) △H1=-116kJ·mol-1,是放热反应,温度越低,转化率越高,所以曲线X对应的温度是230℃,故答案为:230℃。
CH3OH(g) △H1=-116kJ·mol-1,是放热反应,温度越低,转化率越高,所以曲线X对应的温度是230℃,故答案为:230℃。
(ii)a点时,CO的转化率为50%,反应消耗了1mol×50%=0.5molCO,消耗氢气1mol,生成0.5mol甲醇,剩余0.5molCO,n(H2)=0.5mol, a点平衡时各组分的浓度是c(CH3OH)=0.5mol/L,c(CO)=0.5mol/L,c(H2)=0.5mol/L,则K= c(CH3OH)/ [c(CO) c2(H2)]=![]() =4,故答案为:4。
=4,故答案为:4。
(4)根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠,0.2moCO2和100mL3 mol/LNaOH溶液混合,二者的物质的量之比为2:3,所以溶液是物质的量浓度相等的碳酸钠和碳酸氢钠的混合液,混合液显碱性,c(OH-)>c(H+);由于碳酸根离子水解程度大于碳酸氢根离子的水解程度,所以c(HCO3-)>c(CO32-),即c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故答案为:c(Na+)>c(HCO3-)>C(CO32-)>c(OH-)>c(H+)。

【题目】氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。研究氧化亚氮分解对环境保护有重要意义。
(1)污水生物脱氮过程中,在异养微生物催化下,硝酸铵可分解为N2O和另一种产物,该反应的化学方程式为________。
(2)已知反应2N2O(g)=2N2(g) + O2(g)的ΔH= –163 kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945 kJ、498 kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为________ kJ。
(3)在一定温度下的恒容容器中,反应2N2O(g)=2N2(g) + O2(g)的部分实验数据如下:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
C(N2O)/mol/L | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.010 |
①在0~20min时段,反应速率v(N2O)为________ mol·L-1·min-1。
②若N2O起始浓度c0为0.150 mol·L-1,则反应至30min时N2O的转化率α =__________。比较不同起始浓度时N2O的分解速率:v(c0=0.150 mol·L-1) ________ v(c0=0.100 mol·L-1)(填“>”、“=”或“<”)。
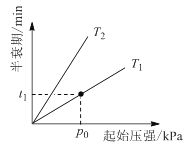
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1________T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1 min时,体系压强p =________(用p0表示)。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g) ![]() 2I(g) (快反应)
2I(g) (快反应)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是________(填标号)。
A.N2O分解反应中,k(含碘)> k(无碘) B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大 D.I2浓度与N2O分解速率无关