题目内容
【题目】已知硫酸钠晶体(Na2SO4·10H2O)中钠离子数目3.01×1023,请计算填空:
(1)钠离子的物质的量是_____,硫酸钠晶体的物质的量是______。
(2)所含硫酸根离子的物质的量是______,硫酸根离子的数目是______。
(3)所含结晶水的物质的量是____,所含氧原子的物质的量是______。
【答案】0.5mol; 0.25mol; 0.25mol; 0.25NA; 2.5mol; 3.5mol。
【解析】
根据n=N/NA计算钠离子物质的量,再根据化学式(Na2SO4·10H2O)的组成进行计算。
(1)钠离子物质的量![]() ,
,
硫酸钠晶体的物质的量n(Na2SO4)=0.5÷2=0.25mol;
故答案为:0.5mol;0.25mol;
(2)硫酸根离子的物质的量n(SO42-)=1×0.25mol=0.25mol;硫酸根离子的数目N(SO42-)=0.25NA;
故答案为:0.25mol,0.25NA;
(3)结晶水的物质的量n(H2O)=10×0.25mol=2.5mol,所含氧原子的物质的量n(O)=14×0.25mol=3.5mol;
故答案为:2.5mol;3.5mol。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】用生产钛白的副产品FeSO4与软锰矿(主要成分是MnO2)可制备高纯MnO2。
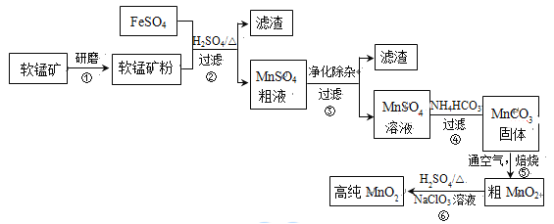
(1)步骤①中研磨的目的是_________。
(2)步骤②中主要发生的反应是FeSO4与MnO2转化为MnSO4与_________。
(3)步骤②中Mn2+浸出率受初始H2SO4浓度与温度的影响如下图所示。

软锰矿粉酸浸的适宜条件是__________。
(4)步骤②中,若硫酸初始浓度小于1.8mol/L,反应进行一段时间后,有红褐色固体析出,其原因是____________。
(5)已知MnSO4粗液中还含有Al3+、Fe3+和Ni2+离子,溶液中离子生成氢氧化物的pH如下表:
Al(OH)3 | Fe(OH)3 | Ni(OH)2 | Mn(OH)2 | |
开始沉淀时pH | 3.4 | 1.5 | 6.9 | 8.2 |
完全沉淀时pH | 4.7 | 2.8 | 8.9 | 10.2 |
注:金属离子的起始浓度为0.1mol/L
步骤③进行的操作是:调节pH=5.4,过滤,滤渣中含_____。
(6)已知:几种难溶物的溶解平衡常数K
化学式 | MnCO3 | NiCO3 | MnS | NiS |
K | 2.24×10-11 | 1.42×10-7 | 4.65×10-14 | 1.07×10-21 |
步骤③还需加入的除杂试剂是_______固体(填序号)。
a.Na2CO3 b.MnCO3 c.Na2S d.MnS
(7)步骤⑤中焙烧MnCO3制MnO2,发生反应的化学方程式是______。固体产物除MnO2外,还可能存在______。



