题目内容
【题目】一定条件下,在密闭容器中发生反应:2CO(g)![]() C(s)+CO2(g)。
C(s)+CO2(g)。
①下列能说明该反应达到平衡的是___________。
A.CO和CO2的浓度之比为1∶1
B.CO和CO2的物质的量之比不再变化
C.混合气体的平均摩尔质量不再变化
D.形成amolC=O键的同时断裂amolC![]() O键
O键
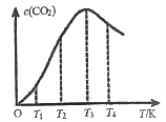
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c(CO2)随温度的变化如上图所示,则该反应为________(填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,T℃时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为_______。在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=__________。
【答案】BC放热40%0.02a mol·min-1
【解析】
①A.CO和CO2的浓度之比为1:1,可能是反应进行到某一时刻的情况,不一定是平衡状态,故A不能判断该反应达到化学平衡状态;
B.CO和CO2的物质的量之比不再变化,说明各物质的浓度保持不变,故B能判断该反应达到化学平衡状态;
C.此反应是反应前后气体体积改变的反应,反应体系中有固体物质,气体总物质的量也发生改变,当容器内混合气体的平均摩尔质量不再变化,说明反应达到平衡,故C能判断该反应达到化学平衡状态;
D.形成amolC=O键,即生成![]() molCO2,为正反应;断裂amolC
molCO2,为正反应;断裂amolC![]() O键,即消耗amolCO,为也正反应,故D不能判断该反应达到化学平衡状态;
O键,即消耗amolCO,为也正反应,故D不能判断该反应达到化学平衡状态;
故答案为:BC;
②T3对应的点为刚达到平衡点,T3对应的点后为平衡受温度影响的情况,即升温,CO2的物质的量浓度c(CO2)减小,平衡左移,故正反应的![]() H<0,则该反应为放热反应。
H<0,则该反应为放热反应。
故答案为:放热;
③设转化的CO的物质的量为xmol,则:
2CO(g)![]() C(s)+CO2(g)
C(s)+CO2(g)
起始(mol) a 0 0
变化(mol) x ![]()
![]()
平衡(mol) a-x ![]()
![]()
依据题意有,![]() 100%=75%,解得:x=0.4a。
100%=75%,解得:x=0.4a。
CO的平衡转化率为:![]() 100%=
100%=![]() 100%= 40%;
100%= 40%;
0-10min内平均反应速率v(CO2)=![]() =
=![]() = 0.02a mol·min-1。
= 0.02a mol·min-1。
故答案为:40%;0.02a mol·min-1。

 口算题天天练系列答案
口算题天天练系列答案